
【题目】关于下列装置说法正确的是( )
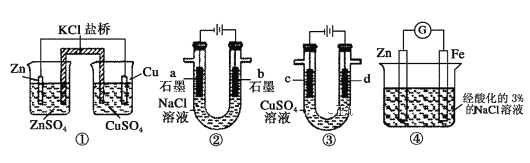
A.装置①中,一段时间后CuSO4浓度增大
B.装置②中滴入酚酞,a极附近变红
C.用装置③精炼铜时,c极为粗铜
D.装置④中发生吸氧腐蚀
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
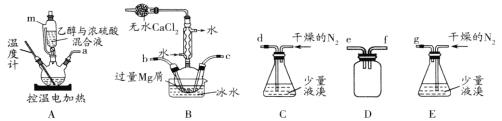
已知:①乙醚的熔点为-116.3℃,沸点为34.6℃。
②Mg和Br2反应非常剧烈,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
③不考虑氮气与镁的反应
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,使溴分子缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤,将滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
请回答下列问题:
(1)装置A中使用仪器m的优点是_______;
(2)步骤I中所选装置的正确连接顺序是a _____(填小写字母),装置D的作用是____;
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________;
(4)实验中不能用干燥空气代替干燥N2,原因是___________;
(5)有关步骤V的说法,正确的是____;
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+-络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式为:Mg2+ + Y4-=MgY2-,Mg2+-络黑T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为____________________;
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0.0500 mol·L-1 EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00 mL,则测得无水MgBr2产品的纯度是___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气催化重整反应是生产氢能的有效方法之一。
(1)甲醇水蒸气重整制氢存在以下副反应:(已知a、b均大于零)
Ⅰ:甲醇分解 :CH3OH(g) CO(g)+2H2(g) △H= +akJ·mol-1
Ⅱ:水蒸气变换:CO(g)+H2O(g)CO2(g)+ H2(g) △H= ![]() kJ·mol-1
kJ·mol-1
催化重整反应:CH3OH(g) +H2O(g)CO2(g)+ 3H2(g) △H=________kJ·mol-1
(2)甲醇分解与水蒸气变换反应Kp与温度关系见下表:
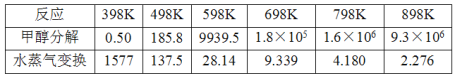
①698K时.CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的Kp=___________。(保留小数点后二位)
②在较高温度下进行该反应.发现平衡时体系中CO含量偏高的原因是_____________。
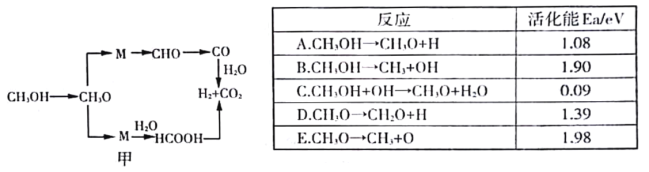
(3)甲醇水蒸气重整反应的可能机理如图甲所示.结合下表分析CH3OH →CH3O的主要反应为______________(填序号),解释原因______________________________________________________________。
(4)某研究小组对重整反应温度(T)与水醇比(![]() )进行优化,得到图乙、丙。
)进行优化,得到图乙、丙。
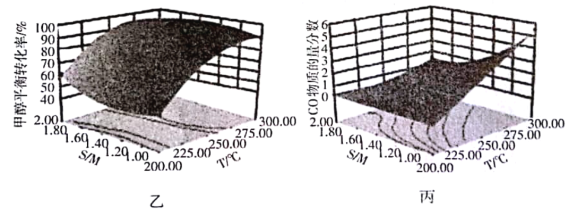
结合图乙分析温度、水醇比与甲醇平衡转化率的关系:________________.
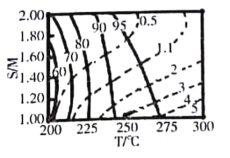
②在图中用阴影画出最优化的反应条件区域(下图为乙和丙组合的平面图,实线为甲醇平衡转化率,虚线为CO物质的量分数):______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.1 mol CuOB.0.1 mol CuCO3
C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础。如图为两套实验装置。

(1)写出下列实验仪器的名称A___;B___;C__;D___。
(2)用装置1分离四氯化碳和Br2的混合物,实验操作的名称为___,冷凝管的进水口是___;(填a或b);
(3)现需配制480mL 0.2mol/L KOH溶液,需要称量KOH___g,配制过程中所用到的仪器有托盘天平、烧杯、___、___、胶头滴管。
(4)装置2是某同学转移溶液的示意图,图中的错误是___。
(5)下列操作会引起浓度偏高的是___。
A.溶液未冷却到室温就转移至容量瓶中 B.称量固体时将右边放药品与左边放砝码
C.定容时仰视读数 D.容量瓶中的水未除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
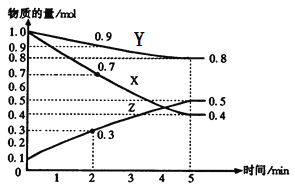
(1)由图中的数据分析,该反应的化学方程式为_____________________。
(2)反应开始至5min,Z的平均反应速率为__________;
(3)反应开始至5min,正反应速率逐渐______;(填“增大”“减小”)逆反应速率逐渐______,(填“增大”“减小”)5min后Z的物质的量不再改变,原因是下列的________;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施一定能使正反应速率增大的是______。
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为从海带中提取碘的工业生产过程,有关说法错误的是()
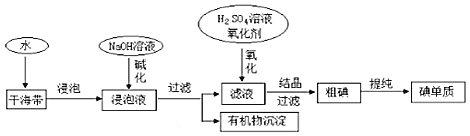
A.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com