
【题目】某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
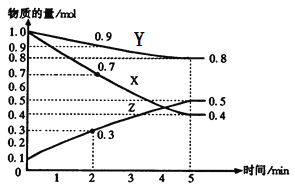
(1)由图中的数据分析,该反应的化学方程式为_____________________。
(2)反应开始至5min,Z的平均反应速率为__________;
(3)反应开始至5min,正反应速率逐渐______;(填“增大”“减小”)逆反应速率逐渐______,(填“增大”“减小”)5min后Z的物质的量不再改变,原因是下列的________;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施一定能使正反应速率增大的是______。
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
【答案】3X+Y![]() 2Z 0.04 mol·(L·min)-1 减小 增大 C AC
2Z 0.04 mol·(L·min)-1 减小 增大 C AC
【解析】
(1)根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式;
(2)根据v=△c/△t计算反应速率;
(3)浓度越大,反应速率越大,浓度变小,反应速率变小,当达到平衡状态时,各组分量不再改变;
(4)升高温度,正逆反应速率均增大,增大组分浓度,反应速率增大。
(1)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第5分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.6mol、0.2mol,Z的生成的物质的量为0.4mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y![]() 2Z;
2Z;
(2)Z的平均反应速率v=△c/△t=(0.5mol-0.1mol)/(2L×5min)=0.04mol/(L·min);
(3)反应开始至5min,反应物X、Y的物质的量减小,生成物Z的物质的量增加,故正反应速率逐渐减小;逆反应速率逐渐增大,当达到平衡状态时,正逆反应速率相等,各组分量不再改变,故答案为:减小;增大;C;
(4)A.升高温度,正逆反应速率均增大,故A正确;
B. 降低温度,正逆反应速率均减小,故B错误;
C. 增大Y的浓度,正反应速率增大,故C正确;
D. 减少Z的浓度,正反应速率减小,故D错误。
故答案为:AC。


科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
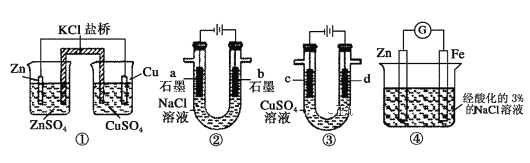
A.装置①中,一段时间后CuSO4浓度增大
B.装置②中滴入酚酞,a极附近变红
C.用装置③精炼铜时,c极为粗铜
D.装置④中发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写中正确的是
A.氢氧化镁与盐酸反应:H++OH-=H2O
B.铁与盐酸反应:2Fe+6H+=2Fe3++3H2
C.氧化铝溶于稀硫酸:Al2O3+6H+=2Fe3++3H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3 胶体:Fe3++3H2O=Fe(OH)3+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含(NH4)2SO4和K2SO4的混合溶液100mL,向其中滴加足量的Ba(OH)2溶液,加热,充分反应,生成的气体在标准状况下体积为448 mL,将反应后的溶液过滤得白色沉淀4.66 g。求原混合溶液中K2SO4的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
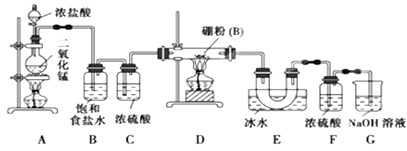
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.在硫酸工业的吸收塔中,采用浓硫酸吸收三氧化硫
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2与过量氨水反应得到![]()
D.无水CoCl2吸水会变为蓝色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO(g)![]() N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
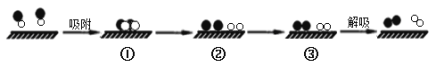
A.①B.②C.③D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com