
【题目】某含(NH4)2SO4和K2SO4的混合溶液100mL,向其中滴加足量的Ba(OH)2溶液,加热,充分反应,生成的气体在标准状况下体积为448 mL,将反应后的溶液过滤得白色沉淀4.66 g。求原混合溶液中K2SO4的物质的量浓度________。
【答案】0.1mol/L
【解析】
滴加足量的Ba(OH)2溶液,加热,充分反应生成的气体在标准状况下体积为448mL,该气体为氨气;将反应后的溶液过滤得白色沉淀4.66g,该沉淀为硫酸钡,根据n=![]() 计算出硫酸钡的物质的量,根据
计算出硫酸钡的物质的量,根据![]() 计算出氨气的物质的量,先利用N原子守恒计算出硫酸铵的物质的量,再利用硫酸根离子守恒计算出硫酸钾的物质的量,最后根据c=
计算出氨气的物质的量,先利用N原子守恒计算出硫酸铵的物质的量,再利用硫酸根离子守恒计算出硫酸钾的物质的量,最后根据c=![]() 计算出硫酸钾的物质的量浓度。
计算出硫酸钾的物质的量浓度。
(NH4)2SO4+Ba(OH)2=BaSO4↓+ 2NH3↑ + 2H2O,K2SO4+ Ba(OH)2= BaSO4↓ + 2KOH,生成的4.66g沉淀为硫酸钡,硫酸钡的物质的量为![]() =0.02mol,生成的气体为氨气,标准状况下448mL氨气的物质的量为
=0.02mol,生成的气体为氨气,标准状况下448mL氨气的物质的量为![]() =0.02mol,根据N原子守恒可知混合液中(NH4)2SO4的物质的量为0.02mol×
=0.02mol,根据N原子守恒可知混合液中(NH4)2SO4的物质的量为0.02mol×![]() =0.01mol,则混合液中K2SO4的物质的量为:0.02mol-0.01mol=0.01mol,所以混合液中硫酸钾的物质的量浓度为
=0.01mol,则混合液中K2SO4的物质的量为:0.02mol-0.01mol=0.01mol,所以混合液中硫酸钾的物质的量浓度为![]() =0.1mol/L,答:原混合溶液中K2SO4的物质的量浓度为0.1mol/L。
=0.1mol/L,答:原混合溶液中K2SO4的物质的量浓度为0.1mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为___,F化学式为___;
(2)B和R在溶液中反应生成F的离子方程式为___;
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,由此反应可知A有作为___的用途。
(5)M投入盐酸中的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.1 mol CuOB.0.1 mol CuCO3
C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定是高中化学重要的定量实验。请回答下列问题:
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是____(填选项字母)。
A.滴定终点读数时,俯视滴定管刻度
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.02mol·L-1的高锰酸钾溶液滴定,发生反应的离子方程式为:____。
(3)一滴定数据如下:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为____(填离子)对该反应具有催化作用,KMnO4溶液应装在____(填“酸”或“碱”)式滴定管中;滴定终点的现象是____。
②该草酸溶液的物质的量浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
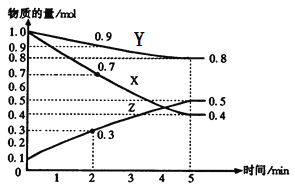
(1)由图中的数据分析,该反应的化学方程式为_____________________。
(2)反应开始至5min,Z的平均反应速率为__________;
(3)反应开始至5min,正反应速率逐渐______;(填“增大”“减小”)逆反应速率逐渐______,(填“增大”“减小”)5min后Z的物质的量不再改变,原因是下列的________;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施一定能使正反应速率增大的是______。
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关注饮用水,保证生活质量。请回答下列问题:
(1)饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为: 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为: 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
上述反应中,_________元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子。当有1mol N2生成时,反应中转移电子的数目为____________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳 [Ca(OH)2]制取漂白粉,化学方程式为:__________________。
(3)KA1(SO4)212H2O的俗名为明矾,因其溶于水生成_____________(化学式)可以吸附杂质,从而达到净水作用。向饱和明矾溶液滴加稀氢氧化钠溶液至过量,用离子方程式和必要文字描述过程现象:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4(s)受热分解制备氧气是实验室制氧气的常用方法,它也是一种高效氧化剂,是氧化还原滴定实验中常用的试剂,可以作为标准溶液滴定一些具有还原性的物质(Fe2+、C2O42-等)的溶液,如5C2O42-+2MnO4-+l6H++4H2O=2[Mn(H2O)6]2++10CO2↑。
(1)基态Mn2+的核外电排布式为___。
(2)如果在空气中焙烧KMnO4,可获得Mn3O4(可改写为MnOMn2O3),则Mn3O4中Mn的化合价为___。
(3)石墨烯(如图A)是一种由碳原子组成六边形呈蜂巢晶格的二维碳纳米材料,当石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图B)。
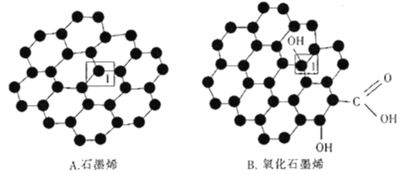
石墨烯结构中1号C的杂化方式为___;该C与相邻的两个C形成的键角___(填“>”“<”“=”)l20。氧化石墨烯结构中1号C与相邻C___(填“有”或“没有”)形成π键。
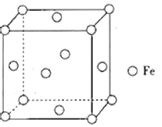
(4)铁形成的晶体类型因为铁原子排列方式的不同而不同,其中一种晶胞结构如图所示。晶体中铁原子周围距离最近且等距的铁原子数为___。形成铁碳合金时,存在一种碳原子插入到晶胞中每条棱的中点和晶胞的体心的结构,该物质的化学式为___;设NA为阿伏加德罗常数的值,该铁碳晶胞的晶胞参数为apm,则C原子间的最短距离为______pm,该铁碳晶胞的密度为___ gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是

A.该有机物易溶于水
B.可以与Na2CO3生成2molCO2
C.该分子对称性好,所以没有顺反异构
D.该有机物分子中,最多可能有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属钠和镁,请根据下列工艺生产流程回答问题。

(1)海水提取镁要用到海滩上的贝壳,贝壳煅烧过程中发生反应的化学方程式为___。
(2)母液中加入石灰乳反应的离子方程式为__。
(3)若在空气中加热MgCl2·6H2O生成的是Mg(OH)Cl或MgO,而MgO的熔沸点非常高,达到熔融状态需要消耗很多能源。所以,用电解法制取金属镁时,需要无水氯化镁。写出用电解法制取金属镁的化学方程式___。
(4)在以上提取镁的过程中,没有涉及的化学反应类型是__。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com