
【题目】甲醇水蒸气催化重整反应是生产氢能的有效方法之一。
(1)甲醇水蒸气重整制氢存在以下副反应:(已知a、b均大于零)
Ⅰ:甲醇分解 :CH3OH(g) CO(g)+2H2(g) △H= +akJ·mol-1
Ⅱ:水蒸气变换:CO(g)+H2O(g)CO2(g)+ H2(g) △H= ![]() kJ·mol-1
kJ·mol-1
催化重整反应:CH3OH(g) +H2O(g)CO2(g)+ 3H2(g) △H=________kJ·mol-1
(2)甲醇分解与水蒸气变换反应Kp与温度关系见下表:
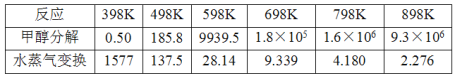
①698K时.CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的Kp=___________。(保留小数点后二位)
②在较高温度下进行该反应.发现平衡时体系中CO含量偏高的原因是_____________。
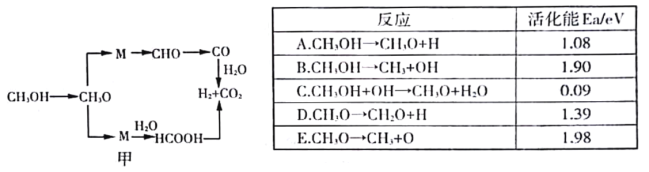
(3)甲醇水蒸气重整反应的可能机理如图甲所示.结合下表分析CH3OH →CH3O的主要反应为______________(填序号),解释原因______________________________________________________________。
(4)某研究小组对重整反应温度(T)与水醇比(![]() )进行优化,得到图乙、丙。
)进行优化,得到图乙、丙。
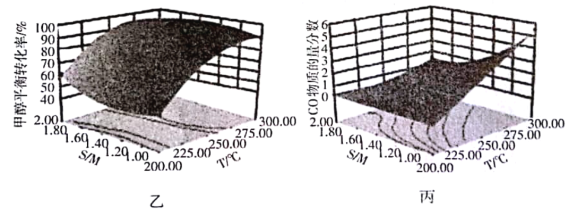
结合图乙分析温度、水醇比与甲醇平衡转化率的关系:________________.
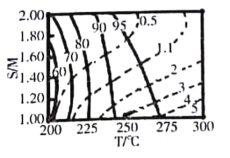
②在图中用阴影画出最优化的反应条件区域(下图为乙和丙组合的平面图,实线为甲醇平衡转化率,虚线为CO物质的量分数):______________
【答案】a-b ![]() 温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高 A 反应C的活化能最小,但反应C要用到反应B生成的OH,而反应B活化能非常大,不易发生反应,除了C,反应A活化能小最容易反应,所以主要反应为A; 升高温度,水醇比越大,甲醇转化率越大
温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高 A 反应C的活化能最小,但反应C要用到反应B生成的OH,而反应B活化能非常大,不易发生反应,除了C,反应A活化能小最容易反应,所以主要反应为A; 升高温度,水醇比越大,甲醇转化率越大 
【解析】
(1)根据盖斯定律,目标方程为甲醇分解、水蒸气变换两方程叠加,焓变为a-b;
(2) ①Ⅰ、甲醇分解:CH3OH(g) CO(g)+2H2(g)的平衡常数为KP1,Ⅱ、水蒸气变换:CO(g)+H2O(g)CO2(g)+ H2(g)的平衡常数为KP2,反应I+II得到CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的平衡常数KP=KP1×KP2,698K时KP1=1.8×105,KP2=9.339,所以![]() ;
;
②由题给信息知,反应Ⅰ为吸热反应,升高温度,平衡正向移动,使体系中CO含量增大;反应Ⅱ为放热反应,升高温度,平衡逆向移动,也使体系中CO含量增大,故平衡体系中CO含量高;
故答案为:![]() ;温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高;
;温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高;
(3) 反应C的活化能最小,但反应C要用到反应B生成的OH,而反应B活化能非常大,不易发生反应,除了C,反应A活化能小最容易反应,所以主要反应为A;
(4) ①图乙是温度、水醇比与甲醇的平衡转化率的关系图,分析可知:当水醇比一定时如1.00,温度升高,甲醇的平衡转化率增大,温度一定(200℃)时,水醇比减小则甲醇的平衡转化率降低,所以温度、水醇比与甲醇的平衡转化率的关系为温度越高、水醇比相对越大,甲醇的平衡转化率越高;
②由图可知:甲醇的平衡转化率最高(为100%)所在曲线与CO的物质的量分数最低(为0.5%)所在曲线围成的区域即为最优化的反应条件区域:温度260℃左右、水醇比1.8以上,此时甲醇的平衡转化率最高,CO的物质的量分数最低,如图阴影部分: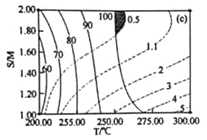 ;
;
故答案为:升高温度,水醇比越大,甲醇转化率越大; 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
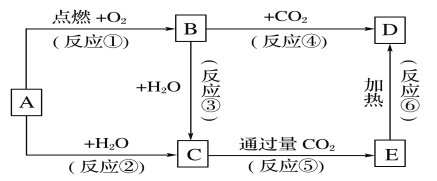
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。
请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
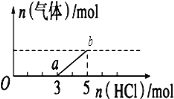
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活密切相关,请回答:
(1)在生活中要注意饮食平衡,蛋白质属于_______(填序号,下同)食物,番茄属于______食物;①酸性 ②碱性
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用______(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是_____;由于具有兴奋作用,国际奥委会严禁运动员服用的是_________;
(3)苹果汁是人们喜爱的饮品,由于其中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有________(填序号);①氧化性 ②还原性 ③碱性 ④酸性
(4)食用植物油进入人体后,在酶的作用下水解为高级脂肪酸和_________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料;
(5)硫酸亚铁可用于治疗缺铁性贫血,某贫血患者每天须补充1.4g铁元素,则服用的药物中含硫酸亚铁的质量至少为_________g;
(6)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和____(写结构简式或名称).人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸;
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水.写出葡萄糖在体内被氧化的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.硅酸钠溶液与盐酸反应![]() +2HCl=2Cl-+ H2O+SiO2↓
+2HCl=2Cl-+ H2O+SiO2↓
B.水玻璃中通入过量二氧化碳![]() +CO2+H2O=
+CO2+H2O=![]() +H2SiO3↓
+H2SiO3↓
C.硅酸与氢氧化钠溶液反应H2SiO3+ OH-=![]() + H2O
+ H2O
D.SiO2与氢氧化钠溶液反应SiO2+2OH-=![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”。钛铁矿(主要成分为FeTiO3,含少量Fe2O3、SiO2等杂质)可用来制备TiO2,同时得到副产品绿矾(FeSO4·7H2O),工艺流程如图所示:
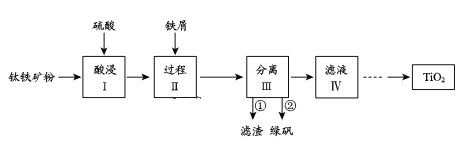
己知:①FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中
(1)酸浸I中Fe2O3与稀硫酸反应的离子方程式:_____。
(2)过程II中加入适量铁屑的目的是____。
(3)分离III中步骤②得到绿矾的操作是_____。
(4)由滤液IV提取TiO2的过程如下:
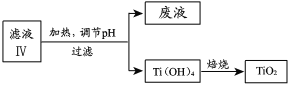
①请用化学平衡移动原理解释滤液加热煮沸的目的:______。
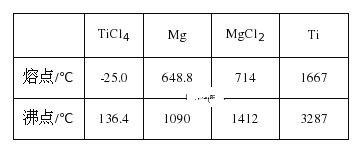
②由2Mg+TiCl4→Ti+2MgCl2反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于___℃即可。
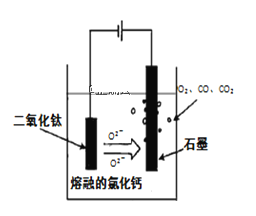
③电解TiO2制备钛的方法如图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
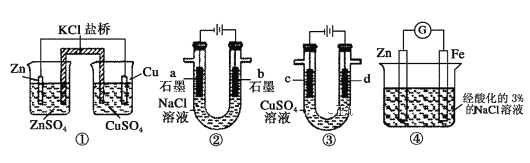
A.装置①中,一段时间后CuSO4浓度增大
B.装置②中滴入酚酞,a极附近变红
C.用装置③精炼铜时,c极为粗铜
D.装置④中发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
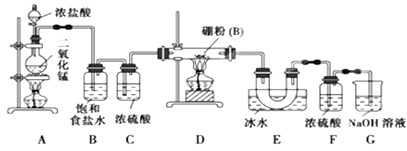
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com