
【题目】下列离子方程式正确的是( )
A.硅酸钠溶液与盐酸反应![]() +2HCl=2Cl-+ H2O+SiO2↓
+2HCl=2Cl-+ H2O+SiO2↓
B.水玻璃中通入过量二氧化碳![]() +CO2+H2O=
+CO2+H2O=![]() +H2SiO3↓
+H2SiO3↓
C.硅酸与氢氧化钠溶液反应H2SiO3+ OH-=![]() + H2O
+ H2O
D.SiO2与氢氧化钠溶液反应SiO2+2OH-=![]() +H2O
+H2O
【答案】D
【解析】
A.硅酸钠溶液与盐酸反应生成氯化钠和硅酸,盐酸为强酸,应写离子形式,硅酸沉淀应写化学式,正确的离子方程式为:SiO32-+2H+=H2SiO3↓,故A不符合题意;
B.在硅酸钠溶液中通入过量的二氧化碳生成硅酸和碳酸氢钠,正确的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故B不符合题意;
C.硅酸和氢氧化钠溶液反应生成硅酸钠和水,电荷不守恒,正确的离子方程式为:H2SiO3+2OH-=SiO32-+2H2O,故C不符合题意;
D.二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,离子方程式:SiO2+2OH-=SiO32-+H2O,故D符合题意;
综上,本题选D。


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
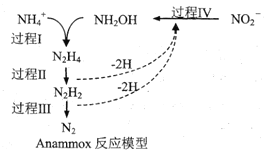
A.1molNH4+所含的质子总数为10NA(设NA为阿伏加德罗常数的值)
B.该方法每处理1molNH4+,需要0.5molNO2-
C.过程IV中,NO2-发生氧化反应
D.N2H2中含有σ键和π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室模拟以粗盐(含杂质Mg2+、Ca2+、K+和SO42-)为原料进行生产并综合利用的某过程如下图所示。已知: Kap[Mg(OH)2]=5.6×10-12;Kap[CaMg(CO3)2]<< Kap[Mg(OH)2]。

(1)过量试剂A是_________________________溶液。(填名称)
(2)图为KCI和NaCl的溶解度曲线,连续操作④是_____________________________。

(3)向滤液IV中通入NH3CO2气体后能够得到NaHCO3的原因是_______________(用必要的化学用语和文字说明)。
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka =3×10-8,工业上用饱和纯碱溶液代替烧碱溶液与Cl2反应生产有效成分为次氯酸钠的消毒液,反应的化学方程式是___________________________________。
(5)经检测,滤液Ⅲ中c(Mg2+)<1.0×10-7 mol/L,则镁元素最终沉淀物是_________________。
(6)⑤处母液可以生产氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工业上制备NCl3的一种方法是用图所示装置电解,其原理是NH4Cl+2HCl![]() NC13十3H2↑。
NC13十3H2↑。

阳极反应式是___________________________________。
(7)电解氯化钠时需要加入一定量氯化钙,根据学习过的电解知识推测加入氯化钙的主要作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为___,F化学式为___;
(2)B和R在溶液中反应生成F的离子方程式为___;
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,由此反应可知A有作为___的用途。
(5)M投入盐酸中的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气催化重整反应是生产氢能的有效方法之一。
(1)甲醇水蒸气重整制氢存在以下副反应:(已知a、b均大于零)
Ⅰ:甲醇分解 :CH3OH(g) CO(g)+2H2(g) △H= +akJ·mol-1
Ⅱ:水蒸气变换:CO(g)+H2O(g)CO2(g)+ H2(g) △H= ![]() kJ·mol-1
kJ·mol-1
催化重整反应:CH3OH(g) +H2O(g)CO2(g)+ 3H2(g) △H=________kJ·mol-1
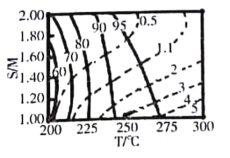
(2)甲醇分解与水蒸气变换反应Kp与温度关系见下表:
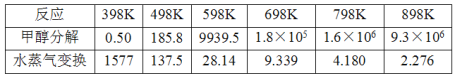
①698K时.CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的Kp=___________。(保留小数点后二位)
②在较高温度下进行该反应.发现平衡时体系中CO含量偏高的原因是_____________。
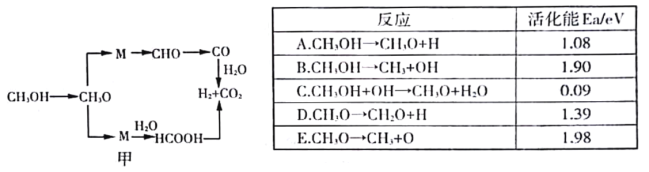
(3)甲醇水蒸气重整反应的可能机理如图甲所示.结合下表分析CH3OH →CH3O的主要反应为______________(填序号),解释原因______________________________________________________________。
(4)某研究小组对重整反应温度(T)与水醇比(![]() )进行优化,得到图乙、丙。
)进行优化,得到图乙、丙。
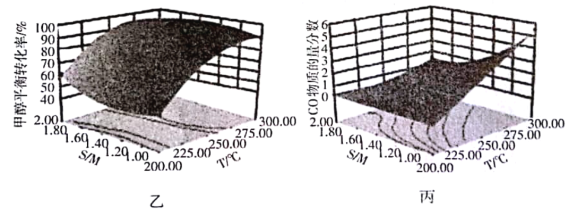
结合图乙分析温度、水醇比与甲醇平衡转化率的关系:________________.
②在图中用阴影画出最优化的反应条件区域(下图为乙和丙组合的平面图,实线为甲醇平衡转化率,虚线为CO物质的量分数):______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.1 mol CuOB.0.1 mol CuCO3
C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4(s)受热分解制备氧气是实验室制氧气的常用方法,它也是一种高效氧化剂,是氧化还原滴定实验中常用的试剂,可以作为标准溶液滴定一些具有还原性的物质(Fe2+、C2O42-等)的溶液,如5C2O42-+2MnO4-+l6H++4H2O=2[Mn(H2O)6]2++10CO2↑。
(1)基态Mn2+的核外电排布式为___。
(2)如果在空气中焙烧KMnO4,可获得Mn3O4(可改写为MnOMn2O3),则Mn3O4中Mn的化合价为___。
(3)石墨烯(如图A)是一种由碳原子组成六边形呈蜂巢晶格的二维碳纳米材料,当石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图B)。
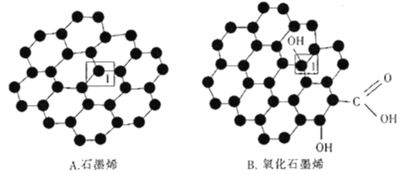
石墨烯结构中1号C的杂化方式为___;该C与相邻的两个C形成的键角___(填“>”“<”“=”)l20。氧化石墨烯结构中1号C与相邻C___(填“有”或“没有”)形成π键。
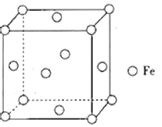
(4)铁形成的晶体类型因为铁原子排列方式的不同而不同,其中一种晶胞结构如图所示。晶体中铁原子周围距离最近且等距的铁原子数为___。形成铁碳合金时,存在一种碳原子插入到晶胞中每条棱的中点和晶胞的体心的结构,该物质的化学式为___;设NA为阿伏加德罗常数的值,该铁碳晶胞的晶胞参数为apm,则C原子间的最短距离为______pm,该铁碳晶胞的密度为___ gcm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com