
【题目】下列有关物质检验的实验操作、现象及结论均正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为SO2 |
D | 向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红 | 该溶液中一定含有NH |
A.AB.BC.CD.D
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中.△H能正确表示物质的燃烧热的是( )
A.CO(g) +![]() O2(g) ==CO2(g); △H=-283.0 kJ/mol
O2(g) ==CO2(g); △H=-283.0 kJ/mol
B.C(s) +![]() O2 ==CO(g); △H=-110.5 kJ/mol
O2 ==CO(g); △H=-110.5 kJ/mol
C.H2(g) +![]() O2(g)==H2O(g); △H=-241.8 kJ/mol
O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16 CO2(g)+18 H2O(l); △H=-1136 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于强电解质的是___,属于弱电解质的是__,属于非电解质的是__。(填序号)
①氨气 ②醋酸钠 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氢氟酸 ⑦乙醇
(2)一定条件下,醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+ΔH>0
CH3COO-+H+ΔH>0
①下列方法中,可使0.10mol·L-1醋酸溶液中CH3COOH电离平衡向左移的是___。
a.加入少量0.10mol·L-1的稀盐酸 b.加热
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
②已知在25℃时,醋酸和亚硫酸的电离平衡常数分别为:醋酸:K=1.75×10-5,亚硫酸:K1=1.54×10-2 K2=1.02×10-7,则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH___H2SO3(填“>”、“<”或“=”)。
③25℃时,向0.10mol·L-1CH3COOH溶液中加入少量盐酸,使溶液中[OH-]=5.0×10-13mol·L-1,则该溶液的pH=__。(已知:lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图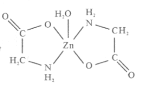 。
。
(1)基态Zn2+的价电子排布式为_______________;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是___________________。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为______________;甘氨酸易溶于水,试从结构角度解释___________________________________________。
(3)一水合甘氨酸锌中Zn2+的配位数为______________________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有________个σ键。
,则1 mol IMI中含有________个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物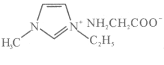 为液态而非固态,原因是________________________________________。
为液态而非固态,原因是________________________________________。
(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
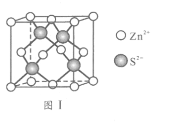
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2- 、Zn2+相切?_________(填“能”或“否”);已知晶体密度为d g/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防晒剂(M)![]() 的合成路线如图所示,根据信息回答下列问题:
的合成路线如图所示,根据信息回答下列问题:

已知:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
![]()
②R1CHO+R2CH2CHO![]() +H2O
+H2O
(1)M中醚键是一种极其稳定的化学键,除此之外还含有官能团的名称为___。
(2)物质B的名称___。
(3)C的结构简式___;D→E转化过程中第①步的化学反应方程式___。
(4)完成Ⅴ的反应条件是___;Ⅳ的反应类型为___。
(5)A也是合成阿司匹林(![]() )的原料,
)的原料,![]() 有多种同分异构体。写出符合下列条件的同分异构体有___种。写出苯环上的一氯代物有两种符合下列条件的同分异构体的结构简式___(任写出一种)
有多种同分异构体。写出符合下列条件的同分异构体有___种。写出苯环上的一氯代物有两种符合下列条件的同分异构体的结构简式___(任写出一种)
a.苯环上有3个取代基
b.仅属于酯类,能发生银镜反应,且每摩该物质反应时最多能生成4molAg
(6)以F及乙醛为原料,合成防晒剂![]() 的路线为___(用流程图表示)。流程示例:CH2=CH2
的路线为___(用流程图表示)。流程示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡的标志是( )
2NH3(g)达到化学平衡的标志是( )
A.NH3的生成速率与NH3的分解速率相等
B.单位时间内生成a mol N2同时生成3a mol H2
C.单位时间内生成a mol N2同时消耗a mol H2
D.单位时间内有1 mol N≡N键断裂同时有3 mol H—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为20mL、浓度均为0.1mol·L-1的两种酸HX、HY分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
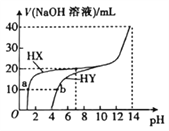
A. Ka(HY)的数量级约为10-3
B. a点c(X-)>b点c(Y-)
C. HX发生反应的离子方程式为HX+OH-=X-+H2O
D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。5min末达到平衡,有关数据如表。
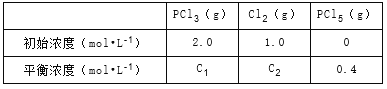
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08molL-1min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达平衡时,c(PCl5)<0.2molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com