
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图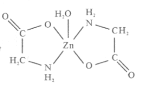 。
。
(1)基态Zn2+的价电子排布式为_______________;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是___________________。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为______________;甘氨酸易溶于水,试从结构角度解释___________________________________________。
(3)一水合甘氨酸锌中Zn2+的配位数为______________________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有________个σ键。
,则1 mol IMI中含有________个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物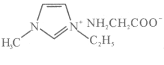 为液态而非固态,原因是________________________________________。
为液态而非固态,原因是________________________________________。
(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
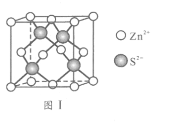
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2- 、Zn2+相切?_________(填“能”或“否”);已知晶体密度为d g/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
【答案】3d10 O>N>C>H sp3 甘氨酸为极性分子,且分子中的氨基和羧基都能与水分子形成氢键 5 12NA 阴阳离子半径大,电荷小,形成的离子晶体晶格能小,熔点低 正四面体 否 (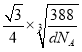 ×1010-a)pm
×1010-a)pm
【解析】
(1)Zn的核电荷数为30,处于周期表中第4周期第ⅡB族,基态Zn2+的价电子排布式为3d10;
C、N、O是同一周期的元素,从左到右电负性减小,电负性由大到小的顺序是O>N>C>H。
(2)N原子价层电子对个数是4,杂化轨道类型为sp3;
从分子极性和氢键两个角度解释;
(3)根据配位数的定义判断;
(4)1 mol IMI中含有5molC-N、6molC-H、1molC-H,共12×6.02×1023个σ键。
(5)从晶格能大小的角度解释;
(6)S2-做面心立方最密堆积,Zn2+做四面体填隙,根据结合晶胞边长和体对角线的关系、密度公式ρ=m÷V计算。
(1)Zn为30号元素,基态Zn2+的价电子排布式为3d10;一水合甘氨酸锌中所涉及的非金属元素C、N、O、H,C、N、O是同一周期的元素,从左到右电负性减小,电负性由大到小的顺序是O>N>C>H。
(2)甘氨酸(H2N-CH2-COOH)中N原子形成三个σ键,孤电子对为![]() =1,N原子价层电子对个数是4,杂化轨道类型为sp3;
=1,N原子价层电子对个数是4,杂化轨道类型为sp3;
甘氨酸易溶于水,因为:甘氨酸极性分子,且分子中的氨基和羧基都能与水分子形成氢键。
(3)Zn与甘氨酸中的氧和氮原子形成4个配位键,和水中氧形成一个配位键,一水合甘氨酸锌中Zn2+的配位数为5。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有5molC-N、6molC-H、1molC-H,共12×6.02×1023个σ键。
,则1 mol IMI中含有5molC-N、6molC-H、1molC-H,共12×6.02×1023个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物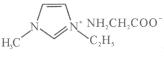 为液态而非固态,原因是阴阳离子半径大,电荷小,形成的离子晶体晶格能小,熔点低。
为液态而非固态,原因是阴阳离子半径大,电荷小,形成的离子晶体晶格能小,熔点低。
(6)①S2-为面心立方最密堆积,Zn2+做四面体填隙,所以晶体中与Zn2+等距且最近的S2-形成的立体图形为正四面体形,Zn2+填入S2-组成的正四面体空隙中;
②由①不能判断出S2- 、Zn2+相切;晶体的密度为dg·cm-3,阿伏伽德罗常数为NA,一个晶胞中含有Zn2+的个数为4,S2-的个数为8×![]() +6×
+6×![]() =4个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,设晶胞的边长为Ccm,一个晶胞的体积为V=c3cm3,则晶体密度为ρ=
=4个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,设晶胞的边长为Ccm,一个晶胞的体积为V=c3cm3,则晶体密度为ρ=![]() =
=![]() ,所以C=
,所以C=![]() cm,由于晶体中Zn2+和S2-原子之间的最短距离为体对角线的
cm,由于晶体中Zn2+和S2-原子之间的最短距离为体对角线的![]() ,所以该晶体中S2-和Zn2+之间的最短距离为
,所以该晶体中S2-和Zn2+之间的最短距离为![]() cm=
cm=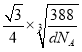 cm,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为(
cm,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为(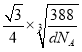 ×1010-a)pm。
×1010-a)pm。


科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
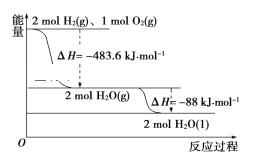
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。
Ⅰ.实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如下图。
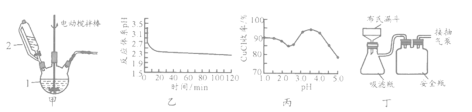
回答以下问题:
(1)甲图中仪器1的名称是________;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为_________(填“A”或“B”)。
A、CuSO4-NaCl混合液 B、Na2SO3溶液
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式_______________;丙图是产率随pH变化关系图,实验过程中往往用CuSO4- Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是___________________________并维持pH在____________左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。
抽滤所采用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是________________________(写一条);
洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是____________________________。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
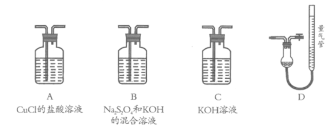
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(4)装置的连接顺序应为_______→D
(5)用D装置测N2含量,读数时应注意______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:aA(g)+bB(g)![]() cC(g)。某化学兴趣小组研究了其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是( )
cC(g)。某化学兴趣小组研究了其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是( )

A.如图1反应:若p1>p2,则该反应只能在高温下自发进行
B.如图2反应:此反应的ΔH<0,且T1<T2
C.如图3反应:表示t1时刻一定是使用催化剂对反应速率的影响
D.如图3反应:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有希望成为新能源汽车的电源,其结构如图所示,下列说法正确的是( )

A.电子从金属锂流出通过外电路流向石墨烯,固体电解质允许通过水
B.放电时,正极反应式:O2+4e-+4H+=2H2O
C.应用该电池电镀铜,阴极质量增加64g,理论上将消耗11.2LO2
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.具有相同通式的有机物不一定互为同系物
B.分子组成相差一个或若干个CH2原子团的化合物一定互为同系物
C.分子式为C3H8与C6H14的两种有机物一定互为同系物
D.两个相邻同系物的相对分子质量数值一定相差14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验操作、现象及结论均正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为SO2 |
D | 向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红 | 该溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法中,错误的是( )
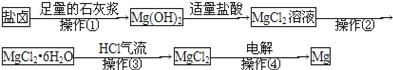
A. 操作①发生的反应为非氧化还原反应
B. 操作②是蒸发浓缩结晶过滤
C. 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
D. 在整个制备过程中,未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物种类繁多,请以你对有机物的认识填空:
(1)下列几组物质中,互为同位素的是__,互为同素异形体的是__,互为同系物的是___,互为同分异构体的是___。
①O2和O3;②35Cl和37Cl;③CH3CH3和CH3CH2CH3;④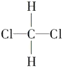 和
和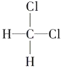 ;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥
;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥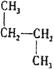 和
和![]() ;⑦
;⑦![]() 和CH3(CH2)3CH3;
和CH3(CH2)3CH3;
(2)下列各烷烃的沸点由高到低的顺序为___(用字母表示)
A.正戊烷 B.异戊烷 C.CH3(CH2)2CH3 D.新戊烷 E.C3H8
(3)聚乙烯可用于制造食品包装袋,由乙烯制备聚乙烯的化学方程式为___。
(4)丙烯中处于同一平面的原子最多有___个,丙烯使溴水褪色,其化学方程式为___,该反应的类型是___。
(5)1mol某烷烃完全燃烧时消耗氧气的物质的量为11mol,其化学式为___,其结构中含有3个-CH3的结构简式分别为:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com