
����Ŀ�������-������ؾ��������ܶȸߵ��ŵ㣬��ϣ����Ϊ����Դ�����ĵ�Դ����ṹ��ͼ��ʾ������˵����ȷ���ǣ� ��

A.���Ӵӽ��������ͨ�����·����ʯīϩ��������������ͨ��ˮ
B.�ŵ�ʱ��������Ӧʽ��O2+4e-+4H+=2H2O
C.Ӧ�øõ�ص��ͭ��������������64g�������Ͻ�����11.2LO2
D.����ˮ�Ե��Һ���ɹ������������ʣ�����������������̼����
���𰸡�D
��������
A��Li����ˮ��Ӧ����ԭ��ع���ʱ���������ʲ�����ͨ��ˮ����A����
B���ŵ�ʱ������O2�õ��ӷ�����ԭ��Ӧ������OH-���缫��Ӧʽ��O2+4e-+2H2O=4OH-����B����
C��û��˵���Ƿ��DZ�״��������Ħ�������֪����������������������㣬��C����
D�����Һ���ɹ������������ʣ�������������Li2O������������̼������������������������������D��ȷ��
�ʴ�ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ4 NH3��g����5O2��g��![]() 4NO��g����6 H2O��g��,����������ȷ����
4NO��g����6 H2O��g��,����������ȷ����
A��NH3��H2O��ѧ��Ӧ���ʹ�ϵ��2v����NH3��= 3v����H2O��
B���ﵽ��ѧƽ��ʱ��4v����O2��= 5v����NO ��
C���ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ��٣��淴Ӧ��������
D������λʱ��������x mol NO��ͬʱ������x mol NH3 ����Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����H2���ϳɼ״����ں����ܱ������У��ڴ��������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)������������˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ� ��
CH3OH(g)+H2O(g)������������˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ� ��
A.CO2��H2��CH3OH��H2O���������
B.CO2��H2��CH3OH��H2O��Ũ�����
C.�����淴Ӧ��������ҵ�����
D.CO2��H2��CH3OH��H2O��Ũ�Ⱦ����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������У�����ǿ����ʵ���___������������ʵ���__�����ڷǵ���ʵ���__��������ţ�
�ٰ��� �ڴ����� ������ �ܴ��� �����ᱵ ������� ���Ҵ�
��2��һ�������£�������Һ���ڵ���ƽ�⣺CH3COOH![]() CH3COO����H����H��0
CH3COO����H����H��0
�����з����У���ʹ0.10mol��L��1������Һ��CH3COOH����ƽ�������Ƶ���___��
a����������0.10mol��L��1��ϡ���� b������
c����ˮϡ����0.010mol��L��1 d����������������
����֪��25��ʱ�������������ĵ���ƽ�ⳣ���ֱ�Ϊ�����K��1.75��10��5�������K1��1.54��10��2 K2��1.02��10��7����25��ʱ����ͬŨ�ȴ������������Һ������ǿ����CH3COOH___H2SO3(�����������������)��
��25��ʱ����0.10mol��L��1CH3COOH��Һ�м����������ᣬʹ��Һ��[OH��]=5.0��10��13mol��L��1�������Һ��pH��__������֪��lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ����������������Ź㷺����;��
(1)�Ҵ��Ĺ�������_______��
(2)��ҵ�����У�����ϩ��ˮ��Ӧ�Ƶ��Ҵ����÷�Ӧ����Ϊ_________��
(3)�Ҵ������ᷴӦ���Ƶ������������������������Ľṹ��ʽΪ___________��
(4)�Ҵ���ͭ�����������¿ɱ�����Ϊ��ȩ��д����Ӧ�Ļ�ѧ����ʽ__________��
(5)������ʹ�þƾ�����������������˾���Ƿ�Ƽݣ���ԭ���ǣ�˾�����к������Ҵ�����ʹ������еij�ɫ�ظ����(K2Cr2O7)ת��Ϊ��ɫ�������[Cr2(SO4)3]��������Ӧ�漰���Ҵ�������________��
A.��ɫҺ�� B.�ܶȱ�ˮ��С C.�ӷ� D.���л�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һˮ�ϸʰ���п��һ�ֿ������������Ӽ����ṹ��ʽ��ͼ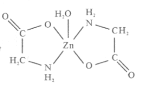 ��
��
��1����̬Zn2+�ļ۵����Ų�ʽΪ_______________��һˮ�ϸʰ���п�����漰�ķǽ���Ԫ�ص縺���ɴ�С��˳����___________________��
��2���ʰ��ᣨH2N-CH2-COOH����N���ӻ��������Ϊ______________���ʰ���������ˮ���Դӽṹ�ǶȽ���___________________________________________��
��3��һˮ�ϸʰ���п��Zn2+����λ��Ϊ______________________��
��4�� [Zn(IMI)4](ClO4)2��Zn2+����һ������IMI�ĽṹΪ![]() ����1 mol IMI�к���________���Ҽ���
����1 mol IMI�к���________���Ҽ���
��5��������IMI��ij����������ʰ����γɵ����ӻ�����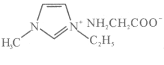 ΪҺ̬���ǹ�̬��ԭ����________________________________________��
ΪҺ̬���ǹ�̬��ԭ����________________________________________��
��6��Zn��S�γ�ij�ֻ�����ľ�����ͼ����ʾ��
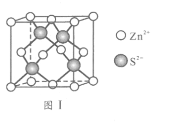
��Zn2+����S2-��ɵ�________________��϶�У�
���ɢ��ܷ��жϳ�S2- ��Zn2+���У�_________����ܡ�������֪�����ܶ�Ϊd g/cm3��S2-�뾶Ϊa pm����ҪʹS2-��Zn2+���У���Zn2+�뾶Ϊ____________________pm��д�������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ǻ����л�����ԭ�ϣ��ֿ���Ϊȼ�������������ȼ�ϡ�
��1����ҵ�Ϻϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
ƽ�ⳣ��K | 2.041 | 0.270 | 0.012 |
�ɱ��������жϸ÷�ӦΪ ________��Ӧ�������������������������� ij�¶��£���2 molCO��6 molH2����2 L���ܱ������г�ַ�Ӧ���ﵽƽ����c(CO)��0.2 mol/L����CO��ת����Ϊ______����ʱ���¶�Ϊ______���ӱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g)��2CO2(g)+4H2O(g) ��H1kJ/mol
��2CO(g)+O2(g)��2CO2(g) ��H2kJ/mol
��H2O(g)��H2O(l) ��H3kJ/mol
��ӦCH3OH(l)+O2(g)��CO(g)+2H2O(l) ��H�� _____________ kJ/mol������H1����H2����H3��ʾ����
��3�����Լ״�ȼ�ϵ�أ����õ�ⷨ���������Ժ�����ˮ����Ҫ����Cr2O72��ʱ��ʵ����������ͼװ��ģ��÷���

��N�缫�ĵ缫��ӦʽΪ ___________________________________��
������ɵ�����Cr2O72ת��ΪCr3+�����ӷ�Ӧ����ʽ��
Cr2O72 + ______ Fe2+ + ______ �� ______ Cr3+ + ______ Fe3+ + ______
��4��������ˮʱ�����Cr3+��Cr(OH)3��ʽ��ȥ����c(Cr3+)��1��105 mol/Lʱ��Cr3+������ȫ����ʱ��Һ��pH��______������֪��Ksp=6.4��1031��lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����淴ӦN2��g����3H2��g�� ![]() 2NH3��g���ﵽ��ѧƽ��ı�־�ǣ�������
2NH3��g���ﵽ��ѧƽ��ı�־�ǣ�������
A.NH3������������NH3�ķֽ��������
B.��λʱ��������a mol N2ͬʱ����3a mol H2
C.��λʱ��������a mol N2ͬʱ����a mol H2
D.��λʱ������1 mol N��N������ͬʱ��3 mol H��H������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeSO4��7H2O�㷺����ҽҩ��ҵ����ʵ�����Ʊ�FeSO4��7H2O���������£�

��1����м��ϡ���ᷴӦǰ��Ӧ��10% Na2CO3��Һ���ݼ����ӣ�����Ŀ����_________��
��2�����õ����̷�������������ˮϴ�ӣ���Ŀ�ģ�����ȥ������渽�ŵ���������ʣ���_____________________��
��3��FeSO4��7H2O��ijЩ��Ѫ������Ҫ�ɷ֣���1.5 gij��Ѫ��Ԥ���������100mL��Һ��ʵ������KMnO4��Һͨ��������ԭ�ζ��ⶨ�ò�Ѫ����1.5 g������Ԫ�صĺ�����������100 mL 1.200 �� 10��2 mol��L��1��KMnO4��Һʱ�����ܽ�����Һת��������ƿ�еIJ���������__________________________��
��ʵ���е�KMnO4��Һ��Ҫ�ữ���������ữ������_________________��
a�� ϡ���� b.ϡ���� c��ϡ���� d��Ũ����
KMnO4��ҺӦʢװ��__________�ζ����С��ζ����յ�ʱ������Ϊ____________��
���ζ���ϣ�����ʵ���¼KMnO4����Һ�Ķ������¡�
�ζ�����ʵ������ | 1 | 2 | 3 |
V����Ʒ��/mL | 20.00 | 20.00 | 20.00 |
V��KMnO4��/mL���������� | 0.00 | 0.20 | 0.00 |
V��KMnO4��/mL���ն����� | 15.85 | 15.22 | 14.98 |
�ò�Ѫ������Ԫ�ص���������Ϊ_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com