
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。5min末达到平衡,有关数据如表。
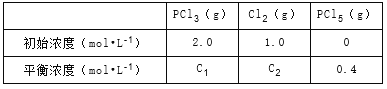
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08molL-1min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达平衡时,c(PCl5)<0.2molL-1
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验操作、现象及结论均正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为SO2 |
D | 向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红 | 该溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() b
b ![]() 的
的![]() 溶液中滴加等体积的
溶液中滴加等体积的![]() 的NaOH溶液,充分反应后溶液中c
的NaOH溶液,充分反应后溶液中c![]() c
c![]() ,下列说法不正确的是
,下列说法不正确的是
A.b![]()
B.混合后溶液呈中性
C.向![]() 溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
D.![]() 的电离常数
的电离常数 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物种类繁多,请以你对有机物的认识填空:
(1)下列几组物质中,互为同位素的是__,互为同素异形体的是__,互为同系物的是___,互为同分异构体的是___。
①O2和O3;②35Cl和37Cl;③CH3CH3和CH3CH2CH3;④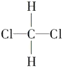 和
和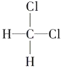 ;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥
;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥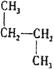 和
和![]() ;⑦
;⑦![]() 和CH3(CH2)3CH3;
和CH3(CH2)3CH3;
(2)下列各烷烃的沸点由高到低的顺序为___(用字母表示)
A.正戊烷 B.异戊烷 C.CH3(CH2)2CH3 D.新戊烷 E.C3H8
(3)聚乙烯可用于制造食品包装袋,由乙烯制备聚乙烯的化学方程式为___。
(4)丙烯中处于同一平面的原子最多有___个,丙烯使溴水褪色,其化学方程式为___,该反应的类型是___。
(5)1mol某烷烃完全燃烧时消耗氧气的物质的量为11mol,其化学式为___,其结构中含有3个-CH3的结构简式分别为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
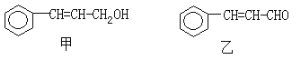
(1)乙中所含官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
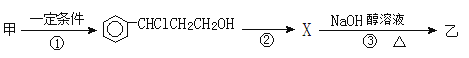
设计步骤①的目的是_________________________,反应②的化学方程式为_________________(注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是_______________(填序号)。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
(4)乙经氢化和氧化得到丙(![]() )。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
)。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0mol·L-1<c1<0.14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,t2、t3、t4、t5时刻各改变一种条件,且改变的条件均不同。若t4时刻改变的条件是压强,则下列说法错误的是( )
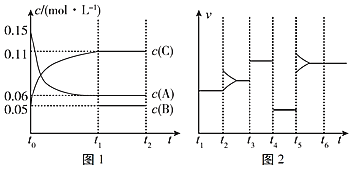
A.若t1=15s,则前15s的平均反应速率υ(C)=0.004molL﹣1s﹣1
B.该反应的化学方程式为3A![]() B+2C
B+2C
C.t2、t3、t5时刻改变的条件可能分别是增大反应物浓度、加入催化剂、升高温度
D.若t1=15s,则B的起始物质的量为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com