
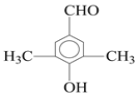
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
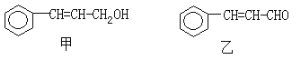
(1)乙中所含官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
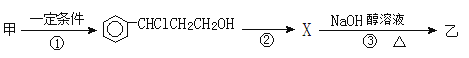
设计步骤①的目的是_________________________,反应②的化学方程式为_________________(注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是_______________(填序号)。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
(4)乙经氢化和氧化得到丙(![]() )。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
)。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
【答案】醛基、碳碳双键 保护碳碳双键 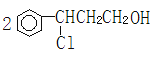 +O2
+O2![]()
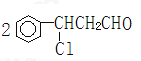 +2H2O D
+2H2O D 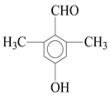
【解析】
(1)由乙的结构简式,可知含有的官能团为碳碳双键、醛基;
(2)由反应①产物的结构,可知反应①是甲与HCl发生加成反应生成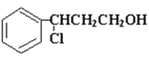 ,反应②发生催化氧化生成X为
,反应②发生催化氧化生成X为![]() ,反应③是X在氢氧化钠醇溶液、加热条件下发生消去反应生成
,反应③是X在氢氧化钠醇溶液、加热条件下发生消去反应生成![]() ;
;
(3)用弱氧化剂检验醛基,避免碳碳双键影响;
(4)丙为![]() ,其同分异构体符合:①能发生银镜反应,则含-CHO;②能与FeCl3溶液发生显色反应,则含酚醛基;③分子中有四种不同化学环境的H原子,则苯环上和甲基中各有1种位置的H。
,其同分异构体符合:①能发生银镜反应,则含-CHO;②能与FeCl3溶液发生显色反应,则含酚醛基;③分子中有四种不同化学环境的H原子,则苯环上和甲基中各有1种位置的H。
(1)由乙的结构简式,可知该物质含有的官能团为碳碳双键、醛基;
(2)由反应①产物的结构,可知反应①是甲与HCl发生加成反应生成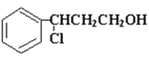 ,反应②发生催化氧化生成X为
,反应②发生催化氧化生成X为![]() ,反应③是X在氢氧化钠醇溶液、加热条件下发生消去反应生成
,反应③是X在氢氧化钠醇溶液、加热条件下发生消去反应生成![]() 。
。
可见设计步骤①的目的是:保护碳碳双键,防止碳碳双键被氧化,反应Ⅰ类型属于加成反应;反应②的化学方程式为: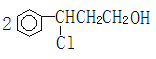 +O2
+O2![]()
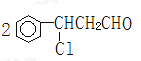 +2H2O;
+2H2O;
(3)酸性高锰酸钾溶液溶液能氧化碳碳双键与醛基,溴水或溴的CCl4溶液中的溴单质能氧化醛基,能与碳碳双键发生加成反应,银氨溶液只能与醛基发生反应,而与碳碳双键不能发生反应,所以可以用银氨溶液检验醛基,故合理选项是D;
(4)丙为![]() ,其同分异构体符合:①能发生银镜反应,说明分子中含-CHO,②能与FeCl3溶液发生显色反应,则含酚羟基,③分子中有四种不同化学环境的H原子,则苯环上和甲基中各有1种位置的H,符合条件的同分异构体为
,其同分异构体符合:①能发生银镜反应,说明分子中含-CHO,②能与FeCl3溶液发生显色反应,则含酚羟基,③分子中有四种不同化学环境的H原子,则苯环上和甲基中各有1种位置的H,符合条件的同分异构体为 、
、 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 H2S与CO2高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)该反应的化学平衡常数表达式K=____________ 。
(2)向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。
A H2S B COS C CO2 D N2
(3)CO2的平衡转化率α1=_____%,反应平衡常数K=__________。(保留两位有效数字)
(4)在600 K重复实验,平衡后水的物质的量分数为0.03,CO2的转化率α2________α1,该反应的ΔH______0(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如右图所示,下列说法正确的是( )

A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水或氢气反应,最多消耗3mol Br2或6molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。5min末达到平衡,有关数据如表。
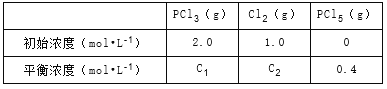
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08molL-1min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达平衡时,c(PCl5)<0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO47H2O晶体在加热条件下会发生分解反应:2FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
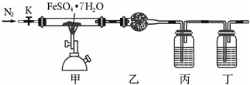
A.实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
B.乙、丙、丁中可依次盛装无水CuSO4、品红溶液、BaCl2溶液
C.还应在丁装置后面连接盛有NaOH溶液的洗气瓶
D.甲中残留固体加稀硫酸溶解,再滴加KSCN溶液,溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是
C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是

A. 反应在前10min的平均反应速率v(B)=0.15mol/(L·min)
B. 该反应的平衡常数表达式K=![]()
C. 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D. 反应至15min时,改变的反应条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入4 mol A,在一定温度和体积可变的密闭容器中发生如下反应:4A(g) ![]() 3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
A. 若向密闭体系内再加入3molB、2molC,达平衡时C的百分含量与原平衡相同
B. 达到平衡时气体的总物质的量、密度都不发生变化
C. 反应达平衡的过程中,释放出的热量不发生变化
D. 升高温度A的转化率大于30%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com