
【题目】已知 H2S与CO2高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)该反应的化学平衡常数表达式K=____________ 。
(2)向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。
A H2S B COS C CO2 D N2
(3)CO2的平衡转化率α1=_____%,反应平衡常数K=__________。(保留两位有效数字)
(4)在600 K重复实验,平衡后水的物质的量分数为0.03,CO2的转化率α2________α1,该反应的ΔH______0(填“>”“<”或“=”)。
【答案】![]() C 10% 2.8×10-3 > <
C 10% 2.8×10-3 > <
【解析】
由题意知①通入H2S,平衡正向移动,但自身转化率减小;通入CO2,平衡正向移动;通入COS,平衡逆向移动;恒容条件下通入N2,平衡不移动。②在600 K重复实验,平衡后水的物质的量分数为0.03,说明升高温度平衡逆向移动;③利用“三段式”计算平衡转化率以及反应平衡常数。
(1)反应方程式为H2S(g)+CO2(g)![]() COS(g)+H2O(g)则化学平衡常数表达式
COS(g)+H2O(g)则化学平衡常数表达式![]() ;
;
故答案为![]() ;
;
(2)A.充入H2S,浓度增大,平衡正向移动,H2S的转化率减小,故A选项错误;
B.充入COS,平衡逆向移动,H2S的转化率减小,故B选项错误;
C.充入CO2,平衡正向移动,H2S的转化率增大,故C选项正确;
D.充入N2,平衡不移动,H2S的转化率不变,故D选项错误;
故答案选C;
(3)由题意设H2S转化的物质的量为x,
H2S(g)+CO2(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
起始(mol)0.40 0.10 0 0
转化(mol) x x x x
平衡(mol)0.40-x 0.10-x x x
已知反应平衡后水的物质的量分数为0.02,则![]() =0.02,解得x=0.01,故CO2的平衡转化率a1=
=0.02,解得x=0.01,故CO2的平衡转化率a1=![]() ×100%=10%;反应平衡常数K=
×100%=10%;反应平衡常数K=![]() ≈2.8×10-3;
≈2.8×10-3;
故答案为10% 2.8×10-3;
(4)水的物质的量分数增大,说明升高温度平衡逆向移动,CO2的转化率a2>a1,且正反应放热,即△H<0;
故答案为> <。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。
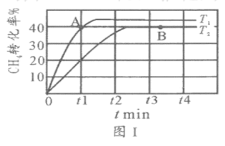
①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
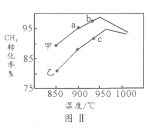
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)反应开始至2min,以气体Z表示的平均反应速率为_________.
(2)该反应的化学方程式为_________.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:此时体系的压强是开始时的_________倍;达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填"增大""减小"或"相等").
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl 是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2·CuCO3, 含FeS、FeO 和SiO2杂质)制备CuCl 的某流程如下

下列说法不正确的是
A.H2O2将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去
B.CO32-作用是控制溶液pH,促使CuCl 沉淀的生成
C.SO32-将溶液3 中的Cu2+还原,反应得到CuCl
D.若改变试剂加入顺序,将溶液3 缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的合成氨的方法如图所示,下列说法错误的是

A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总反应方程式为2N2+6H2O=4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() b
b ![]() 的
的![]() 溶液中滴加等体积的
溶液中滴加等体积的![]() 的NaOH溶液,充分反应后溶液中c
的NaOH溶液,充分反应后溶液中c![]() c
c![]() ,下列说法不正确的是
,下列说法不正确的是
A.b![]()
B.混合后溶液呈中性
C.向![]() 溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
D.![]() 的电离常数
的电离常数 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对大量盆栽鲜花施用了S﹣诱抗素制剂,以保持鲜花盛开,S﹣诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )
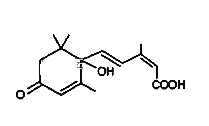
A.与氢气加成最多消耗氢气5mol
B.能发生加成反应、氧化反应、取代反应、缩聚反应
C.1mol该分子能与含2molNaOH的溶液完全反应
D.该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4molBr2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
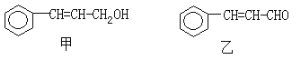
(1)乙中所含官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
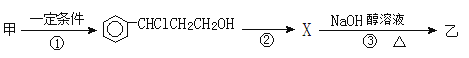
设计步骤①的目的是_________________________,反应②的化学方程式为_________________(注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是_______________(填序号)。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
(4)乙经氢化和氧化得到丙(![]() )。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
)。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com