
【题目】常温下,向![]() b
b ![]() 的
的![]() 溶液中滴加等体积的
溶液中滴加等体积的![]() 的NaOH溶液,充分反应后溶液中c
的NaOH溶液,充分反应后溶液中c![]() c
c![]() ,下列说法不正确的是
,下列说法不正确的是
A.b![]()
B.混合后溶液呈中性
C.向![]() 溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
D.![]() 的电离常数
的电离常数 ![]()
【答案】C
【解析】
常温下,向10mLb![]() 的
的![]() 溶液中滴加等体积的
溶液中滴加等体积的![]()
![]() 的NaOH溶液,充分反应后溶液中
的NaOH溶液,充分反应后溶液中![]() ,依据溶液中电荷守恒c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),则c(H+)=c(OH-),溶液呈中性,若恰好完全反应,生成醋酸钠溶液呈碱性,分析可知醋酸略微过量,
,依据溶液中电荷守恒c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),则c(H+)=c(OH-),溶液呈中性,若恰好完全反应,生成醋酸钠溶液呈碱性,分析可知醋酸略微过量,
A.根据分析,恰好反应生成醋酸钠溶液呈碱性,若溶液呈中性,醋酸过量,![]() ,故A正确;
,故A正确;
B.充分反应后溶液中![]() ,依据溶液中电荷守恒
,依据溶液中电荷守恒![]() ,分析可知
,分析可知![]() ,溶液呈中性,故B正确;
,溶液呈中性,故B正确;
C.![]() 溶液中,水的电离被抑制,随NaOH溶液滴加反应进行,水的抑制程度减弱,水电离程度增大,至溶液为中性,水的电离程度最大,故C错误;
溶液中,水的电离被抑制,随NaOH溶液滴加反应进行,水的抑制程度减弱,水电离程度增大,至溶液为中性,水的电离程度最大,故C错误;
D.根据分析,溶液呈中性, ![]() ,溶液等体积混合,离子浓度减小为原来的一半,
,溶液等体积混合,离子浓度减小为原来的一半,![]() =0.005mol/L,电离平衡常数
=0.005mol/L,电离平衡常数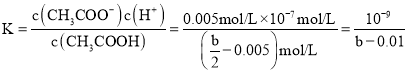 ,故D正确。
,故D正确。
答案选 C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于强电解质的是___,属于弱电解质的是__,属于非电解质的是__。(填序号)
①氨气 ②醋酸钠 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氢氟酸 ⑦乙醇
(2)一定条件下,醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+ΔH>0
CH3COO-+H+ΔH>0
①下列方法中,可使0.10mol·L-1醋酸溶液中CH3COOH电离平衡向左移的是___。
a.加入少量0.10mol·L-1的稀盐酸 b.加热
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
②已知在25℃时,醋酸和亚硫酸的电离平衡常数分别为:醋酸:K=1.75×10-5,亚硫酸:K1=1.54×10-2 K2=1.02×10-7,则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH___H2SO3(填“>”、“<”或“=”)。
③25℃时,向0.10mol·L-1CH3COOH溶液中加入少量盐酸,使溶液中[OH-]=5.0×10-13mol·L-1,则该溶液的pH=__。(已知:lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡的标志是( )
2NH3(g)达到化学平衡的标志是( )
A.NH3的生成速率与NH3的分解速率相等
B.单位时间内生成a mol N2同时生成3a mol H2
C.单位时间内生成a mol N2同时消耗a mol H2
D.单位时间内有1 mol N≡N键断裂同时有3 mol H—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为20mL、浓度均为0.1mol·L-1的两种酸HX、HY分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
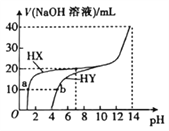
A. Ka(HY)的数量级约为10-3
B. a点c(X-)>b点c(Y-)
C. HX发生反应的离子方程式为HX+OH-=X-+H2O
D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 H2S与CO2高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)该反应的化学平衡常数表达式K=____________ 。
(2)向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。
A H2S B COS C CO2 D N2
(3)CO2的平衡转化率α1=_____%,反应平衡常数K=__________。(保留两位有效数字)
(4)在600 K重复实验,平衡后水的物质的量分数为0.03,CO2的转化率α2________α1,该反应的ΔH______0(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
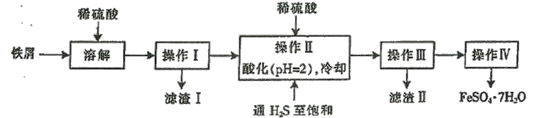
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。根据以上流程图,下列说法不正确的是
A.操作I所得滤液中不含有Fe3+
B.操作Ⅱ中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解
C.操作Ⅱ中,通入H2S至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化。
D.操作Ⅳ中所得的晶体最后用乙醇洗去晶体表面附着的水分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。5min末达到平衡,有关数据如表。
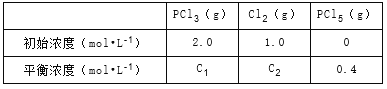
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08molL-1min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达平衡时,c(PCl5)<0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液是中学化学中的非常重要的知识点,请根据要求填空。
(1)向NaHSO3溶液滴加石蕊溶液后变红,则HSO3-的电离程度___其水解程度(填“>”或“=”或“<”)。该物质能___(填“促进”或“抑制”)水的电离。
(2)酸碱中和滴定时,不宜用___(填“酚酞”“石蕊”或“甲基橙” )用作指示剂。用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是___(填字母)。
A.未用标准液润洗碱式滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
(3)醋酸(CH3COOH)是一种弱电解质,25℃时,醋酸的电离平衡常数表达式Ka=___。
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___。若物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),则混合后溶液呈___。
(4)现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
①若它们物质的量浓度相等,它们的pH由大到小的关系为___(用abc表示,下同)。
②若它们的pH相等,它们物质的量浓度由大到小的关系为___。
③若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com