
����Ŀ���������Һ����ѧ��ѧ�еķdz���Ҫ��֪ʶ�㣬�����Ҫ����ա�
��1����NaHSO3��Һ�μ�ʯ����Һ���죬��HSO3-�ĵ���̶�___��ˮ��̶ȣ�����>��������������<��������������___�������ٽ���������������ˮ�ĵ��롣
��2������к͵ζ�ʱ��������___�����̪����ʯ����ȡ� ������ָʾ�����ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ�������___������ĸ����
A.δ�ñ�Һ��ϴ��ʽ�ζ���
B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
C.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
D.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
��3�����ᣨCH3COOH����һ��������ʣ�25��ʱ������ĵ���ƽ�ⳣ������ʽKa��___��
�ٽ�����������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ��___������������������������������������ͬ������Һ��c(Na��)___c(CH3COO��)������>��������������<������
��pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ��___�������ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ��c(Na��)=c(CH3COO��)�����Ϻ���Һ��___��
��4������a.���ᡢb.���ᡢc.����������Һ������Ҫ����⡣
�����������ʵ���Ũ����ȣ����ǵ�pH�ɴ�С�Ĺ�ϵΪ___����abc��ʾ����ͬ����
�������ǵ�pH��ȣ��������ʵ���Ũ���ɴ�С�Ĺ�ϵΪ___��
�������ǵ�pH��ȣ�����ˮϡ��100������pH�ɴ�С�Ĺ�ϵΪ___��
���𰸡��� ���� ʯ�� A��C Ka=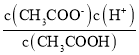 ���� �� ���� ���� a��b��c a��b��c b=c��a
���� �� ���� ���� a��b��c a��b��c b=c��a
��������
(1)NaHSO3��Һ�д���HSO3-�ĵ����ˮ��ƽ�⣬��NaHSO3��Һ�μ�ʯ����Һ���죬��Һ�����ԣ��ݴ˷������
(2)����к͵ζ�ʱ������ʯ��ı�ɫ�����ԣ���������ָʾ�����ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ��������c(����)=![]() �ж���
���
(3)�ٴ���Ϊ���ᣬ������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ�ǡ�����ɴ����ƣ�Ϊǿ�������Σ���Һ�ʼ��ԣ���ϵ���غ��жϣ��ڳ����£�pH=3�Ĵ���Ũ�ȴ���pH=11��NaOH��Һ�����ߵ������Ϻ������ʣ�࣬��Һ�����ԣ����ݵ���غ��жϣ�
(4)��Ũ����ͬ����ҺpH����Һ��������Ũ�ȳɷ��ȣ���pH��ͬʱ����Һ��������Ũ����ͬ��������һԪ���ᣬ�����Ƕ�Ԫǿ�ᡢ������һԪǿ�ᣬ�ݴ��жϣ���pH���ʱ��c(H+)��ȣ�������ϡ�����У���ٽ����룬���������ϡ��ʱ�����ӵ����ʵ������䣬�ݴ˷����жϡ�
(1)NaHSO3��Һ�д���HSO3-�ĵ����ˮ��ƽ�⣬��NaHSO3��Һ�μ�ʯ����Һ���죬��Һ�����ԣ�˵��HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�NaHSO3��Һ�����ԣ��Ե���Ϊ������������������ܹ�����ˮ�ĵ��룬�ʴ�Ϊ���������ƣ�
(2)����к͵ζ�ʱ������ʯ��ı�ɫ�����ԣ���������ָʾ�����ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ����A.δ�ñ�Һ��ϴ��ʽ�ζ��ܣ�ʹ�ñ�����������ҺŨ��ƫС���ζ����ĵ������������ƫ����c(����)=![]() ��c(����)ƫ��A��ȷ��B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ����Ӱ����������ʵ����������������Ƶ�������Խ����Ӱ�죬��B����C.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ����������������Һ�����ƫ����c(����)=
��c(����)ƫ��A��ȷ��B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ����Ӱ����������ʵ����������������Ƶ�������Խ����Ӱ�죬��B����C.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ����������������Һ�����ƫ����c(����)=![]() ��c(����)ƫ��C��ȷ��D.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ����������������Һ�����ƫС������c(����)=
��c(����)ƫ��C��ȷ��D.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ����������������Һ�����ƫС������c(����)=![]() ��c(����)ƫС����D����ѡAC���ʴ�Ϊ��ʯ�AC��
��c(����)ƫС����D����ѡAC���ʴ�Ϊ��ʯ�AC��
(3)����Ϊ������ʣ�����CH3COOH![]() CH3COO-+H+������ĵ���ƽ�ⳣ������ʽKa��
CH3COO-+H+������ĵ���ƽ�ⳣ������ʽKa��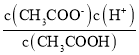 ���ʴ�Ϊ��
���ʴ�Ϊ��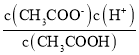 ��
��
�ٽ�������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ�ǡ������CH3COONa��Ϊǿ�������Σ���Һ�ʼ��ԣ�c(OH-)��c(H+)����Һ�д��ڵ���غ㣺c(CH3COO-)+c(OH-)=c(Na+)+c(H+)����c(Na+)��c(CH3COO-)���ʴ�Ϊ�����ԣ�����
�ڳ����£�pH=3�Ĵ���Ũ�ȴ���pH=11��NaOH��Һ�����ߵ������Ϻ������ʣ�࣬��Һ�����ԣ������ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ��c(Na��)=c(CH3COO��)�����ݵ���غ��֪��c(Na+)+c(H+)=c(OH-)+c(CH3COO-)����c(H+)=c(OH-)����ҺΪ���ԣ��ʴ�Ϊ�����ԣ����ԣ�
(4)�ٵ����ǵ����ʵ���Ũ����ͬʱ�����趼��1mol/L��������������Ũ��С��1mol/L��������������Ũ����2mol/L��������������Ũ����1mol/L��������Ũ��Խ��pHԽС������pH�ɴ�С������a��b��c���ʴ�Ϊ��a��b��c��
�� pH��ͬʱ����Һ��������Ũ����ͬ��������һԪ���ᣬ�����Ƕ�Ԫǿ�ᡢ������һԪǿ�ᣬ����������Ũ��Ϊ1mol/L�������Ũ�ȴ���1mol/L������Ũ����1mol/L������Ũ����0.5mol/L���������ʵ���Ũ�ȵ��ɴ�С������a��b��c���ʴ�Ϊ��a��b��c��
��pH���ʱ��c(H+)��ȣ�������ϡ�����У���ٽ����룬���������ӵ����ʵ������ӣ������ӵ�Ũ�ȼ�С�ij̶�С�������������Һ�����������ʵ�����������ȣ������ӵ�Ũ�ȼ�С�ij̶ȴ�����c(H+)�ɴ�С��˳��Ϊ��a��b=c��pH�ɴ�С��˳��Ϊb=c��a���ʴ�Ϊ��b=c��a��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���![]() b
b ![]() ��
��![]() ��Һ�еμӵ������
��Һ�еμӵ������![]() ��NaOH��Һ����ַ�Ӧ����Һ��c
��NaOH��Һ����ַ�Ӧ����Һ��c![]() c
c![]() ������˵������ȷ����
������˵������ȷ����
A.b![]()
B.��Ϻ���Һ������
C.��![]() ��Һ�еμ�NaOH��Һ�Ĺ����У�ˮ�ĵ���̶���С
��Һ�еμ�NaOH��Һ�Ĺ����У�ˮ�ĵ���̶���С
D.![]() �ĵ��볣��
�ĵ��볣�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ij�ܱ������м���0.3mol A��0.1mol C��һ������B�������壬ͼ1��ʾ������Ũ����ʱ��ı仯��ϵ��ͼ2��ʾ������ʱ��ı仯��ϵ��t2��t3��t4��t5ʱ�̸��ı�һ���������Ҹı����������ͬ����t4ʱ�̸ı��������ѹǿ��������˵���������(����)
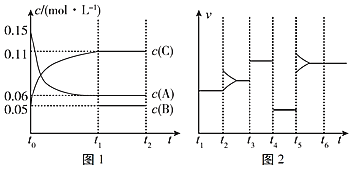
A.��t1��15s����ǰ15s��ƽ����Ӧ������(C)��0.004molL��1s��1
B.�÷�Ӧ�Ļ�ѧ����ʽΪ3A![]() B+2C
B+2C
C.t2��t3��t5ʱ�̸ı���������ֱܷ�������Ӧ��Ũ�ȡ���������������¶�
D.��t1��15s����B����ʼ���ʵ���Ϊ0.02mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶������ܱ������з������¿��淴Ӧ��2M(g)��N(g)![]() 2E(g)������ʼʱֻ����2mol E(g)����ƽ��ʱ��E��ת����Ϊ40%������ʼʱ����2mol M��1mol N�Ļ�����壬��ƽ��ʱ��������ѹǿ����ʼʱ������(����)
2E(g)������ʼʱֻ����2mol E(g)����ƽ��ʱ��E��ת����Ϊ40%������ʼʱ����2mol M��1mol N�Ļ�����壬��ƽ��ʱ��������ѹǿ����ʼʱ������(����)
A.20%B.40%C.60%D.80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں�ѹ��NO��O2����ʼŨ��һ���������£�����Ӧ��ͬʱ�䣬��ò�ͬ�¶���NOת��ΪNO2��ת������ͼ��ʵ����ʾ(ͼ�����߱�ʾ��ͬ������NO��ƽ��ת�������¶ȵı仯)������˵����ȷ����

A. ��Ӧ2NO(g)+O2(g)![]() 2NO2(g)����H>0
2NO2(g)����H>0
B. ͼ��X����ʾ�����£��ӳ���Ӧʱ�������NOת����
C. ͼ��Y����ʾ�����£�����O2��Ũ�Ȳ������NOת����
D. 380���£�c��ʼ(O2)=5.0��104 mol��L1��NOƽ��ת����Ϊ50%����ƽ�ⳣ��K>2000
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼��⼼��������ԭ���ԭ������������ˮ��һ�ֹ��գ�װ����ͼ�����϶˿��ڹرգ��ɵõ�ǿ��ԭ�Ե�H�� (��ԭ��)�����϶˿��ڴ�������������ɵõ�ǿ�����Ե���OH (�ǻ����ɻ�)������˵���������( )��
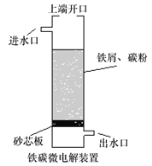
A.�����Ƿ��������������ĵ缫��Ӧʽ��ΪFe-2e-=Fe2+
B.���������ʱ�������ĵ缫��ӦʽΪH++e-= H��
C.�������ʱ��ÿ����1mol��OH��2mol���ӷ���ת��
D.�������в���(H2C2O4)����ˮʱ���϶˿��ڲ���ҪӦ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϻ�������ij�Ͻ����(��Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe�����еȻ��ý���)�Ĺ����������£�
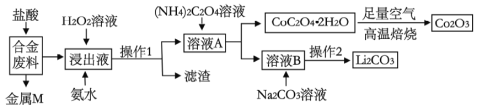
(1)�Ͻ�����м��������ȡ���˴�����ܻ�Ϊ���ᣬԭ����_______________��
(2)����1�õ��IJ���������__________________________��
(3)����Һ�м���H2O2��Һ�Ͱ�ˮ��Ӧ�ȼ���_____________�����백ˮ������Ӧ�����ӷ���ʽΪ____________________��
(4)�ڿ����б���CoC2O4��2H2O�Ļ�ѧ����ʽ��____________________��
(5)��֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ���±�
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
�����2�ľ���������_______________��_____________��ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������ʯ�����Һ����Ҫ��Fe3+������һ������Al3+��Mn2+��Ca2+��Mg2+�ȣ�Ϊԭ���Ʊ��ߴ����������������£�

��֪��������ؽ������������������������pH���±���
�������� | Fe3+ | Fe2+ | Al3+ |
��ʼ������pH | 1.1 | 5.8 | 3.0 |
������ȫ��pH | 3.2 | 8.8 | 5.0 |
��1������ԭ��ʱ��Ӧѡ��_____________������ĸ����
A��Zn�� B��NaClO��Һ C��Fe��
��2��������������Ҫ�ɷֳ���������MnF2�⣬������_____________���ѧʽ����
��3�������̡�ʱ����֪��Ksp(MnS)��4.65��10�C14��Ϊȷ��������ȫ[����Һ��c(Mn2��)��1.0��10�C6 mol��L1]��Ӧ������Һ��c(S2-)��_____________mol��L��1��
��4����������ʱ��������ҺpH�ķ�ΧΪ_____________��
��5����������ʱ����������K2Cr2O7��Һ����Ƿ����δ�������Ľ������ӣ��÷�Ӧ�����ӷ���ʽΪ_____________��
��6����������ʱ����Ӧ�¶�Ϊ85�������£���Ӧʱ��ͷ�Ӧ�յ�pH�����ij����ʵ�Ӱ��ֱ�����ͼ��ʾ������ѵĹ���������_____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йظ���ж�����������ȷ����![]()
A.![]() ����ˮ���ܵ��磬��C
����ˮ���ܵ��磬��C![]() Ϊ�����
�����
B.![]() ��
��![]() ��
��![]() ��
��![]() ��Ϊͬ��������
��Ϊͬ��������
C.NaCl��Һ��![]() ��Һ�������ԣ�������Һ��ˮ�ĵ���̶���ͬ
��Һ�������ԣ�������Һ��ˮ�ĵ���̶���ͬ
D.��Һ�뽺�屾������Ϊ��ɢ����ֱ���Ĵ�С��ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com