
【题目】运用有关概念,判断下列叙述正确的是![]()
A.![]() 溶于水后能导电,故C
溶于水后能导电,故C![]() 为电解质
为电解质
B.![]() 、
、![]() 、
、![]() 、
、![]() 互为同素异形体
互为同素异形体
C.NaCl溶液和![]() 溶液均显中性,故两溶液中水的电离程度相同
溶液均显中性,故两溶液中水的电离程度相同
D.溶液与胶体本质区别为分散质微粒直径的大小不同
【答案】D
【解析】
A.电解质必须是自身电离产生的离子导电;
B.同种元素的不同单质,互为同素异形体;
C.![]() 促进水的电离;
促进水的电离;
D.当分散剂是水或其它物质时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm)。
A.二氧化碳溶于水后能导电,是由与水反应生成的碳酸电离出离子而导电,二氧化碳不能自身电离,所以二氧化碳为非电解质,故A错误;
B.![]() 、
、![]() 、
、![]() 、
、![]() 是化合物,不是单质,故B错误;
是化合物,不是单质,故B错误;
C.![]() 促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故C错误;
促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故C错误;
D.当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液![]() 小于
小于![]() 、胶体
、胶体![]() 、浊液
、浊液![]() 大于
大于![]() ,所以,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,故D正确;
,所以,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】电解质溶液是中学化学中的非常重要的知识点,请根据要求填空。
(1)向NaHSO3溶液滴加石蕊溶液后变红,则HSO3-的电离程度___其水解程度(填“>”或“=”或“<”)。该物质能___(填“促进”或“抑制”)水的电离。
(2)酸碱中和滴定时,不宜用___(填“酚酞”“石蕊”或“甲基橙” )用作指示剂。用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是___(填字母)。
A.未用标准液润洗碱式滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
(3)醋酸(CH3COOH)是一种弱电解质,25℃时,醋酸的电离平衡常数表达式Ka=___。
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___。若物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),则混合后溶液呈___。
(4)现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
①若它们物质的量浓度相等,它们的pH由大到小的关系为___(用abc表示,下同)。
②若它们的pH相等,它们物质的量浓度由大到小的关系为___。
③若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干、灼烧至质量不变,最终不能得到纯净物的是
A.向漂白粉浊液中通入过量的![]()
B.向带有氧化膜的铝片中加入盐酸
C.向含有![]() 的溶液中加入
的溶液中加入![]()
D.向含有![]() 的溶液中加入
的溶液中加入![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质(A、B、C、D)的物质的量变化如图所示,对该反应的推断合理的是 ( )

A. M点表示v(A)=v(B)
B. 0~6 s内,v(A)∶v(B)∶v(C)∶v(D)=3∶1∶1.5∶2
C. 反应进行到6 s时,各物质的物质的量浓度相等
D. 反应进行到6 s时,C的平均反应速率为 0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应 Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)设计成如图所示原电池。下列说法中正确的是( )

A. 电极X是正极,其电极反应为Cu-2e-== Cu2+
B. 银电极板质量逐渐减小,Y溶液中c(Ag+)增大
C. 当X电极质量变化0.64 g时,Y溶液质量变化2.16 g
D. 外电路中电流由银极流向铜极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成乙酸乙酯的路线如下:
CH2=CH2![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
请回答下列问题:
(1)写出乙烯的电子式_________________。
(2)C2H5OH、 CH3COOH分子中的官能团名称分别是____________、____________。
(3)写出下列反应的反应类型:①______________,②_____________。
(4)乙烯能发生聚合反应,其产物的结构简式为______________。
(5)写出下列反应的化学方程式:
反应②:________;
反应④:_________。
(6)实验室用如图装置制备乙酸乙酯:
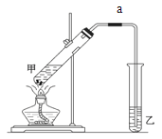
甲试管中碎瓷片的作用是______;导管a的作用是_______________;乙试管中饱和碳酸钠溶液的作用是:________ ; ________;该装置图中有一个明显的错误是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:

下列说法正确的是( )
A.该反应的△H>0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用高温高压的条件,目的都是提高原料气的转化率
D.t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是![]()
A.![]()
![]() 的
的![]() 溶液:
溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.甲基橙呈红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.使KSCN显血红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两种微粒不属于同种元素原子的是![]()
A.M层全充满而N层为![]() 的原子和位于第四周期第IB族的原子
的原子和位于第四周期第IB族的原子
B.2p能级有一个空轨道的基态原子和最外层电子数是次外层电子数二倍的原子
C.价电子排布为![]() 的原子和原子序数为20的原子
的原子和原子序数为20的原子
D.3p能级有两个空轨道的基态原子和M层电子数为1的原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com