
【题目】合成乙酸乙酯的路线如下:
CH2=CH2![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
请回答下列问题:
(1)写出乙烯的电子式_________________。
(2)C2H5OH、 CH3COOH分子中的官能团名称分别是____________、____________。
(3)写出下列反应的反应类型:①______________,②_____________。
(4)乙烯能发生聚合反应,其产物的结构简式为______________。
(5)写出下列反应的化学方程式:
反应②:________;
反应④:_________。
(6)实验室用如图装置制备乙酸乙酯:
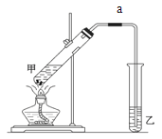
甲试管中碎瓷片的作用是______;导管a的作用是_______________;乙试管中饱和碳酸钠溶液的作用是:________ ; ________;该装置图中有一个明显的错误是__________________。
【答案】![]() 羟基 羧基 加成反应 氧化反应
羟基 羧基 加成反应 氧化反应 ![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O 防止暴沸 导气冷凝回流 吸收挥发出来的乙酸和乙醇 降低乙酸乙酯在水中的溶解度,便于分层析出 导气管的出口伸入到液面以下
CH3COOCH2CH3+H2O 防止暴沸 导气冷凝回流 吸收挥发出来的乙酸和乙醇 降低乙酸乙酯在水中的溶解度,便于分层析出 导气管的出口伸入到液面以下
【解析】
由合成流程可知,乙烯与水发生加成反应生成乙醇,乙醇发生催化氧化生成乙醛,乙醛进一步氧化生成乙酸,乙酸、乙醇发生酯化反应生成乙酸乙酯,据此分析解答(1)~(5);
(6)碎瓷片可防止液体剧烈沸腾,导管a可导气、冷凝回流,饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,实验中要防止发生倒吸,据此分析解答。
(1)乙烯的结构简式为CH2=CH2,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)C2H5OH、CH3COOH分子中的官能团分别是羟基、羧基,故答案为:羟基;羧基;
(3)反应①中碳碳双键转化为碳碳单键,在双键碳原子上分别加上H和-OH,为加成反应;反应②中-OH转化为-CHO,为氧化反应,故答案为:加成反应;氧化反应;
(4)乙烯能发生加成聚合反应,产物的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)反应②为乙醇的催化氧化,反应的化学方程式为2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;反应④为乙酸和乙醇的酯化反应,反应的化学方程式为CH3COOH+CH3CH2OH
2CH3CHO+2H2O;反应④为乙酸和乙醇的酯化反应,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:2CH3CH2OH+O2
CH3COOCH2CH3+H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;CH3COOH+CH3CH2OH
2CH3CHO+2H2O;CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(6)由制备乙酸乙酯的实验装置可知,甲试管中碎瓷片可以防止液体暴沸;导管a可以导气兼冷凝回流;乙试管中饱和碳酸钠溶液的作用是:吸收挥发出来的乙酸和乙醇、降低乙酸乙酯在水中的溶解度,便于分层析出;该装置图中有一个明显的错误是导气管的出口伸入到液面以下,容易产生倒吸现象,故答案为:防止暴沸; 导气冷凝回流;吸收挥发出来的乙酸和乙醇;降低乙酸乙酯在水中的溶解度,便于分层析出;导气管的出口伸入到液面以下。


科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H· (氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH (羟基自由基)。下列说法错误的是( )。
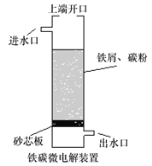
A.无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B.不鼓入空气时,正极的电极反应式为H++e-= H·
C.鼓入空气时,每生成1mol·OH有2mol电子发生转移
D.处理含有草酸(H2C2O4)的污水时,上端开口不需要应打开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①
这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①![]() 试纸检验,溶液的
试纸检验,溶液的![]() ②取少量原溶液,向溶液中加入过量的
②取少量原溶液,向溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入
和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入![]() 振荡,静置后
振荡,静置后![]() 层呈橙色,用分液漏斗分液④向分液后的水溶液中加入
层呈橙色,用分液漏斗分液④向分液后的水溶液中加入![]() 和
和![]() 溶液,有白色沉淀产生⑤在滤液中加入
溶液,有白色沉淀产生⑤在滤液中加入![]() 和
和![]() 的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
A.肯定不存在的离子是![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定存在的离子是![]() 、
、![]() 、
、![]()
C.无法确定原溶液中是否存在![]() 和
和![]()
D.若步骤④改用![]() 和盐酸的混合溶液,则对溶液中离子的判断也无影响
和盐酸的混合溶液,则对溶液中离子的判断也无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念,判断下列叙述正确的是![]()
A.![]() 溶于水后能导电,故C
溶于水后能导电,故C![]() 为电解质
为电解质
B.![]() 、
、![]() 、
、![]() 、
、![]() 互为同素异形体
互为同素异形体
C.NaCl溶液和![]() 溶液均显中性,故两溶液中水的电离程度相同
溶液均显中性,故两溶液中水的电离程度相同
D.溶液与胶体本质区别为分散质微粒直径的大小不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中的许多现象或应用都与化学知识有关。下列现象成应用与胶体性质无关的是( )
A. 将盐卤或石青加人豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用
D. 胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热⑥将稀硫酸换为
固体;④加入少量水;⑤加热⑥将稀硫酸换为![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A 气体和2mol B 气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g) B(g) 2C(g) 。若经 2s 后测得C 的浓度为 0.6mol·L-1,现有下列几种说法:
①用物质A 表示的反应平均速率为 0.3mol·L-1·s-1
②用物质B 表示的反应的平均速率为 0.6mol·L-1·s-1
③2s 时物质A 的转化率为 70%
④2s 时物质B 的浓度为 0.7mol·L-1
其中正确的是( )
A.①③B.①④C.②③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com