
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干、灼烧至质量不变,最终不能得到纯净物的是
A.向漂白粉浊液中通入过量的![]()
B.向带有氧化膜的铝片中加入盐酸
C.向含有![]() 的溶液中加入
的溶液中加入![]()
D.向含有![]() 的溶液中加入
的溶液中加入![]()
【答案】A
【解析】
A.漂白粉的水溶液中通入过量的![]() ,反应后滤液中含有碳酸氢钙、次氯酸、氯化钙,加热蒸干时碳酸氢钙、次氯酸受热分解,氯化氢挥发,残留固体为碳酸钙、氯化钙,是混合物,故A正确;
,反应后滤液中含有碳酸氢钙、次氯酸、氯化钙,加热蒸干时碳酸氢钙、次氯酸受热分解,氯化氢挥发,残留固体为碳酸钙、氯化钙,是混合物,故A正确;
B.氧化铝、金属铝均与盐酸反应生成氯化铝,溶液中氯化铝水解,加热蒸干时HCl挥发,水解彻底进行得到氢氧化铝,灼烧时氢氧化铝分解得到氧化铝,所得固体为纯净物,故B错误;
C.![]() 和水反应生成2mol氢氧化钠,
和水反应生成2mol氢氧化钠,![]() 与2molNaOH恰好反应得到碳酸钙、碳酸钠,滤液为碳酸钠溶液,加热时促进碳酸钠水解,但得到的氢氧化钠又与碳酸氢钠反应生成碳酸钠,最终得到的是碳酸钠,属于纯净物,故C错误;
与2molNaOH恰好反应得到碳酸钙、碳酸钠,滤液为碳酸钠溶液,加热时促进碳酸钠水解,但得到的氢氧化钠又与碳酸氢钠反应生成碳酸钠,最终得到的是碳酸钠,属于纯净物,故C错误;
D.![]() 的溶液中加入
的溶液中加入![]() ,反应得到2mol硫酸钡沉淀和1mol偏铝酸钾,滤液为偏铝酸钾溶液,加热蒸干促进偏铝酸根水解,但最终得到的KOH与氢氧化铝又反应得到偏铝酸钾,最终得到偏铝酸钾,为纯净物,故D错误;
,反应得到2mol硫酸钡沉淀和1mol偏铝酸钾,滤液为偏铝酸钾溶液,加热蒸干促进偏铝酸根水解,但最终得到的KOH与氢氧化铝又反应得到偏铝酸钾,最终得到偏铝酸钾,为纯净物,故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,t2、t3、t4、t5时刻各改变一种条件,且改变的条件均不同。若t4时刻改变的条件是压强,则下列说法错误的是( )
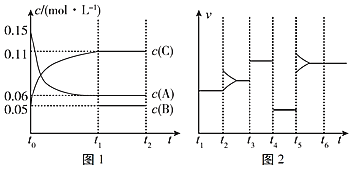
A.若t1=15s,则前15s的平均反应速率υ(C)=0.004molL﹣1s﹣1
B.该反应的化学方程式为3A![]() B+2C
B+2C
C.t2、t3、t5时刻改变的条件可能分别是增大反应物浓度、加入催化剂、升高温度
D.若t1=15s,则B的起始物质的量为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
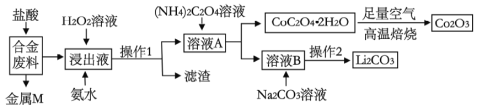
(1)合金废料中加入盐酸浸取,此处盐酸不能换为硝酸,原因是_______________。
(2)操作1用到的玻璃仪器有__________________________。
(3)浸出液中加入H2O2溶液和氨水,应先加入_____________,加入氨水发生反应的离子方程式为____________________。
(4)在空气中焙烧CoC2O4·2H2O的化学方程式是____________________。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
则操作2的具体流程是_______________、_____________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如下图所示。
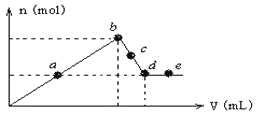
则下列说法正确的是( )
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.b—c段与c—d段溶液中阴离子的物质的量相等
C.在d点,向溶液中加入盐酸,沉淀量将减少
D.在反应过程中,各状态点溶液的pH大小顺序是:e > d > c > a > b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①
这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①![]() 试纸检验,溶液的
试纸检验,溶液的![]() ②取少量原溶液,向溶液中加入过量的
②取少量原溶液,向溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入
和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入![]() 振荡,静置后
振荡,静置后![]() 层呈橙色,用分液漏斗分液④向分液后的水溶液中加入
层呈橙色,用分液漏斗分液④向分液后的水溶液中加入![]() 和
和![]() 溶液,有白色沉淀产生⑤在滤液中加入
溶液,有白色沉淀产生⑤在滤液中加入![]() 和
和![]() 的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
A.肯定不存在的离子是![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定存在的离子是![]() 、
、![]() 、
、![]()
C.无法确定原溶液中是否存在![]() 和
和![]()
D.若步骤④改用![]() 和盐酸的混合溶液,则对溶液中离子的判断也无影响
和盐酸的混合溶液,则对溶液中离子的判断也无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。
(2)如果按图中所示的装置进行试验,求得的中和热数值_______(填“偏大、偏小、无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与(2)中实验相比,所求中和热_________ (填“相等”或“不相等”)。
Ⅱ: (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。已知:C3H8(g) === CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH=CH2(g)=== CH4(g)+ HC≡CH(g ) △H2=+32.4 kJ·mol-1
则C3H8(g) === CH3CH=CH2(g)+H2(g) △H =______________ kJ·mol-1。
(2)发射火箭时用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念,判断下列叙述正确的是![]()
A.![]() 溶于水后能导电,故C
溶于水后能导电,故C![]() 为电解质
为电解质
B.![]() 、
、![]() 、
、![]() 、
、![]() 互为同素异形体
互为同素异形体
C.NaCl溶液和![]() 溶液均显中性,故两溶液中水的电离程度相同
溶液均显中性,故两溶液中水的电离程度相同
D.溶液与胶体本质区别为分散质微粒直径的大小不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴环己烯(![]() )可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
)可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
A.与①反应后的有机产物只有一种
B.与②的反应原理类似于烯烃使溴水褪色
C.与③反应后得到的有机产物可被氧化为醛
D.与④反应后得到的有机产物只有一种官能团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com