
【题目】一定条件下向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,t2、t3、t4、t5时刻各改变一种条件,且改变的条件均不同。若t4时刻改变的条件是压强,则下列说法错误的是( )
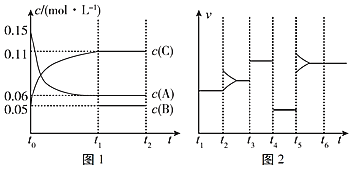
A.若t1=15s,则前15s的平均反应速率υ(C)=0.004molL﹣1s﹣1
B.该反应的化学方程式为3A![]() B+2C
B+2C
C.t2、t3、t5时刻改变的条件可能分别是增大反应物浓度、加入催化剂、升高温度
D.若t1=15s,则B的起始物质的量为0.02mol
【答案】D
【解析】
t4时改变的条件为减小压强,说明反应前后气体的体积相等,t5时正逆反应速率都增大,应是升高温度,t2时正、逆反应速率中只有其中一个增大,应是改变某一物质的浓度,由图甲可知,t1时到达平衡,△c(A)=0.09mol/L,△c(C)=0.06mol/L,二者化学计量数之比为0.09:0.06=3:2,则B为生成物,反应方程式为3A(g)![]() B(g)+2C(g),结合浓度的变化解答该题。
B(g)+2C(g),结合浓度的变化解答该题。
A. 若t1=15s,生成物C在t0t1时间段的平均反应速率为:v=![]() =0.004 molL﹣1s﹣1, A项正确,不符合题意;
=0.004 molL﹣1s﹣1, A项正确,不符合题意;
B. 由以上分析可知反应的化学方程式为:3A(g)![]() B(g)+2C(g),B项正确,不符合题意;
B(g)+2C(g),B项正确,不符合题意;
C. t2时刻该变外界条件,其中某方向速率一瞬间不发生变化,另一方向化学反应速率增大,故t2时刻该变的外加条件为增大反应物浓度,t3时刻该变外界条件,化学反应速率均增大,且正逆化学反应速率相等,故t3时刻该变的外界条件为加入催化剂或压缩体积加压或充入适量A、B、C,t5时刻后正逆化学反应速率均增大,其该变外界条件可能为升温、充入相关参加反应的物质,C项正确,不符合题意;
D. 该反应的方程式为3A(g)![]() B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol0.06mol=0.04mol,D项错误,符合题意;
B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol0.06mol=0.04mol,D项错误,符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡的标志是( )
2NH3(g)达到化学平衡的标志是( )
A.NH3的生成速率与NH3的分解速率相等
B.单位时间内生成a mol N2同时生成3a mol H2
C.单位时间内生成a mol N2同时消耗a mol H2
D.单位时间内有1 mol N≡N键断裂同时有3 mol H—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。5min末达到平衡,有关数据如表。
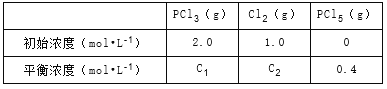
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08molL-1min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达平衡时,c(PCl5)<0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO47H2O晶体在加热条件下会发生分解反应:2FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
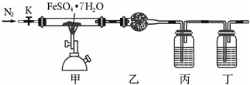
A.实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
B.乙、丙、丁中可依次盛装无水CuSO4、品红溶液、BaCl2溶液
C.还应在丁装置后面连接盛有NaOH溶液的洗气瓶
D.甲中残留固体加稀硫酸溶解,再滴加KSCN溶液,溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A、B 两种气体反应生成 C 气体。反应过程中 A、B、C 浓度变化如图(I)所示 , 若保持其他条件不变,温度分别为 T1和 T2时,B 的体积分数与时间的关系如图(II)所示 ,则下列结论正确的是 ( )

A.该反应的热化学方程式 A(g)+2B(g)=2C(g)△H= -285.84kJmol-1
B.该反应中 T1<T2
C.其他条件不变,升高温度,正、逆反应速率均增大,且 A 的转化率增大
D.T℃时,在相同容器中,若由 0.3 mol/L A、0.1 mol/L B 和 0.4 mol/L C 反 应,达到平衡后,C 的浓度仍为 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是
C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是

A. 反应在前10min的平均反应速率v(B)=0.15mol/(L·min)
B. 该反应的平衡常数表达式K=![]()
C. 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D. 反应至15min时,改变的反应条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液是中学化学中的非常重要的知识点,请根据要求填空。
(1)向NaHSO3溶液滴加石蕊溶液后变红,则HSO3-的电离程度___其水解程度(填“>”或“=”或“<”)。该物质能___(填“促进”或“抑制”)水的电离。
(2)酸碱中和滴定时,不宜用___(填“酚酞”“石蕊”或“甲基橙” )用作指示剂。用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是___(填字母)。
A.未用标准液润洗碱式滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
(3)醋酸(CH3COOH)是一种弱电解质,25℃时,醋酸的电离平衡常数表达式Ka=___。
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___。若物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),则混合后溶液呈___。
(4)现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
①若它们物质的量浓度相等,它们的pH由大到小的关系为___(用abc表示,下同)。
②若它们的pH相等,它们物质的量浓度由大到小的关系为___。
③若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干、灼烧至质量不变,最终不能得到纯净物的是
A.向漂白粉浊液中通入过量的![]()
B.向带有氧化膜的铝片中加入盐酸
C.向含有![]() 的溶液中加入
的溶液中加入![]()
D.向含有![]() 的溶液中加入
的溶液中加入![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com