
【题目】CuCl 是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2·CuCO3, 含FeS、FeO 和SiO2杂质)制备CuCl 的某流程如下

下列说法不正确的是
A.H2O2将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去
B.CO32-作用是控制溶液pH,促使CuCl 沉淀的生成
C.SO32-将溶液3 中的Cu2+还原,反应得到CuCl
D.若改变试剂加入顺序,将溶液3 缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl
科目:高中化学 来源: 题型:
【题目】CO2可与H2催化合成甲醇,于恒容密闭容器中,在催化剂作用下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);下列描述能说明该反应已经达到化学平衡状态的是( )
CH3OH(g)+H2O(g);下列描述能说明该反应已经达到化学平衡状态的是( )
A.CO2、H2、CH3OH、H2O在容器中共存
B.CO2、H2、CH3OH、H2O的浓度相等
C.正、逆反应速率相等且等于零
D.CO2、H2、CH3OH、H2O的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡的标志是( )
2NH3(g)达到化学平衡的标志是( )
A.NH3的生成速率与NH3的分解速率相等
B.单位时间内生成a mol N2同时生成3a mol H2
C.单位时间内生成a mol N2同时消耗a mol H2
D.单位时间内有1 mol N≡N键断裂同时有3 mol H—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为20mL、浓度均为0.1mol·L-1的两种酸HX、HY分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
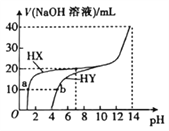
A. Ka(HY)的数量级约为10-3
B. a点c(X-)>b点c(Y-)
C. HX发生反应的离子方程式为HX+OH-=X-+H2O
D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 H2S与CO2高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)该反应的化学平衡常数表达式K=____________ 。
(2)向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。
A H2S B COS C CO2 D N2
(3)CO2的平衡转化率α1=_____%,反应平衡常数K=__________。(保留两位有效数字)
(4)在600 K重复实验,平衡后水的物质的量分数为0.03,CO2的转化率α2________α1,该反应的ΔH______0(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是
C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是

A. 反应在前10min的平均反应速率v(B)=0.15mol/(L·min)
B. 该反应的平衡常数表达式K=![]()
C. 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D. 反应至15min时,改变的反应条件是降低温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com