
【题目】随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。
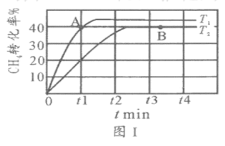
①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。
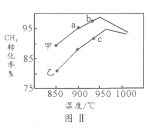
【答案】减小 +249.1 > 1.872 C 一定未 催化剂不会改变平衡转化率,乙催化剂c点未与甲催化剂同样温度的点相交,转化率不相等,说明c点不是平衡转化率 b和a两点反应都未达平衡,b点温度高,反应速率快,相同时间内转化率高(或其它合理答案)
【解析】
(1)降低温度,降低反应混合物中分子所具有的能量;
反应焓变△H=生成物的反应焓之和-反应物的反应焓之和;
(2)①根据图Ⅰ,T1的温度高于T2,速率大;
②由图,A点甲烷的转化率为40%,算出分压,代入公式计算;
(3)A.正反应速率增大,如逆速率同等程度地增加,平衡不移动;
B.向反应体系中投入某生成物,生成物的百分含量增大,但平衡逆向移动;
C.平衡常数K增大,平衡正向进行的程度增大;
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点一定未达到平衡状态,理由是催化剂不会改变平衡转化率,乙催化剂c点未与甲催化剂同样温度的点相交,转化率不相等,说明c点不是平衡转化率;
CH4的转化率b点高于a点的可能原因是:b和a两点反应都未达平衡,b点温度高,反应速率快,相同时间内转化率高(或其它合理答案)。
(1)降低温度,降低反应混合物中分子所具有的能量,该反应速率会减小;
CH 4(g)与CO 2(g)反应生成CO(g)和H 2(g)的方程式:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。根据此定义,稳定单质的摩尔生成焓为0,反应焓变△H=2×(-110.4KJ·mol-1)-[(-395KJ·mol-1)+(-74.9KJ·mol-1)]=+249.1kJ·mol-1,反应的热化学方程式为:CH4(g)+CO2(g)
2CO(g)+2H2(g),CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。根据此定义,稳定单质的摩尔生成焓为0,反应焓变△H=2×(-110.4KJ·mol-1)-[(-395KJ·mol-1)+(-74.9KJ·mol-1)]=+249.1kJ·mol-1,反应的热化学方程式为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)△H=+249.1kJ·mol-1。
2CO(g)+2H2(g)△H=+249.1kJ·mol-1。
(2)①根据图Ⅰ,T1的温度高于T2,A点处v正>B点处;
②由图,A点甲烷的转化率为40%,结合方程式CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),p(CH4)=20KPa×(1-40%)=12kPa=p(CO2),CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=1.3×10-2×12×12mol·g-1·s-1=1.872mol·g-1·s-1。
2CO(g)+2H2(g),p(CH4)=20KPa×(1-40%)=12kPa=p(CO2),CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=1.3×10-2×12×12mol·g-1·s-1=1.872mol·g-1·s-1。
(3)A.正反应速率增大,如逆速率同等程度地增加,平衡不移动,故A不符;
B.向反应体系中投入某生成物,生成物的百分含量增大,但平衡逆向移动,故B不符;
C.平衡常数K增大,平衡正向进行的程度增大,故C符合;
故选C。
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点一定未达到平衡状态,理由是催化剂不会改变平衡转化率,乙催化剂c点未与甲催化剂同样温度的点相交,转化率不相等,说明c点不是平衡转化率;
CH4的转化率b点高于a点的可能原因是:b和a两点反应都未达平衡,b点温度高,反应速率快,相同时间内转化率高(或其它合理答案)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气跟水反应:Cl2 + H2O= 2H++ Cl-+ ClO-
B. 食醋与氨水反应:NH3·H2O+H+= NH4++H2O
C. NaHCO3溶液中加少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D. 向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+恰好沉淀:Ba2++2H++2OH-+SO42- = BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中有可逆反应:nA(g)+mB(g)![]() pC(g) △H>0处于平衡状态(已知m+n>p),则下列说法正确的是
pC(g) △H>0处于平衡状态(已知m+n>p),则下列说法正确的是
①升温,c(B)/c(C)的比值变小
②降温时体系内混合气体平均相对分子质量变小
③加入B,A的转化率增大
④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定降低
⑥若A的反应速率为VA,则B的反应速率为n·VA/m
A.①②③⑤B.①②③④C.①②⑤⑥D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2可与H2催化合成甲醇,于恒容密闭容器中,在催化剂作用下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);下列描述能说明该反应已经达到化学平衡状态的是( )
CH3OH(g)+H2O(g);下列描述能说明该反应已经达到化学平衡状态的是( )
A.CO2、H2、CH3OH、H2O在容器中共存
B.CO2、H2、CH3OH、H2O的浓度相等
C.正、逆反应速率相等且等于零
D.CO2、H2、CH3OH、H2O的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:
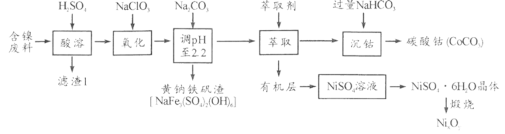
(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________;“滤渣Ⅰ”主要成分为____________________(填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________,为证明添加NaClO3已足量,可用_______________(写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________。
(4)“沉钴”过程的离子方程式________________________。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
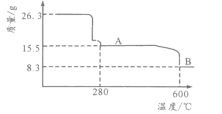
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于强电解质的是___,属于弱电解质的是__,属于非电解质的是__。(填序号)
①氨气 ②醋酸钠 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氢氟酸 ⑦乙醇
(2)一定条件下,醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+ΔH>0
CH3COO-+H+ΔH>0
①下列方法中,可使0.10mol·L-1醋酸溶液中CH3COOH电离平衡向左移的是___。
a.加入少量0.10mol·L-1的稀盐酸 b.加热
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
②已知在25℃时,醋酸和亚硫酸的电离平衡常数分别为:醋酸:K=1.75×10-5,亚硫酸:K1=1.54×10-2 K2=1.02×10-7,则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH___H2SO3(填“>”、“<”或“=”)。
③25℃时,向0.10mol·L-1CH3COOH溶液中加入少量盐酸,使溶液中[OH-]=5.0×10-13mol·L-1,则该溶液的pH=__。(已知:lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在生产生活中有着广泛的用途。
(1)乙醇的官能团是_______。
(2)工业生产中,用乙烯与水反应制得乙醇,该反应类型为_________。
(3)乙醇与乙酸反应可制得香料乙酸乙酯,乙酸乙酯的结构简式为___________。
(4)乙醇在铜作催化剂条件下可被氧化为乙醛,写出反应的化学方程式__________。
(5)交警常使用酒精检测仪来检验机动车司机是否酒驾,其原理是:司机口中呼出的乙醇可以使检测仪中的橙色重铬酸钾(K2Cr2O7)转变为绿色的硫酸铬[Cr2(SO4)3],上述反应涉及的乙醇性质有________。
A.无色液体 B.密度比水的小 C.易挥发 D.具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 H2S与CO2高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)该反应的化学平衡常数表达式K=____________ 。
(2)向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。
A H2S B COS C CO2 D N2
(3)CO2的平衡转化率α1=_____%,反应平衡常数K=__________。(保留两位有效数字)
(4)在600 K重复实验,平衡后水的物质的量分数为0.03,CO2的转化率α2________α1,该反应的ΔH______0(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com