
【题目】常温下,下列叙述错误的是
A.向0.1 mol·L-1的醋酸溶液中加水或通入HCl气体都能使![]() 值增大
值增大
B.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1 mol·L-1某一元酸HA溶液中![]() =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
【答案】B
【解析】
试题分析:A、向0.1 mol·L-1的醋酸溶液中加水则醋酸的电离平衡正向移动,氢离子的物质的量增加,醋酸的物质的量减少,溶液的体积是相同的,所以![]() 增大,通入HCl气体,氢离子浓度增大,平衡逆向移动,醋酸根离子的浓度减小,
增大,通入HCl气体,氢离子浓度增大,平衡逆向移动,醋酸根离子的浓度减小,![]() =Ka/c(CH3COO-),醋酸根离子浓度减小,电离常数不变,则比值增大,正确;B、0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后得到等浓度的醋酸钠和醋酸的混合液,溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,醋酸的电离是微弱的,所以醋酸的浓度大于氢离子浓度,则c(CH3COO-)>c(Cl-)> c(CH3COOH)> c(H+),错误;C、pH=4的醋酸中氢离子浓度与pH=10的氢氧化钠溶液中氢氧根离子的浓度相等,醋酸是弱酸,所以醋酸溶液的浓度大于氢氧化钠溶液的浓度,等体积混合,则醋酸过量,溶液的pH<7,正确;D、酸溶液中的氢氧根离子来自水的电离,Kw=1×10-14,所以
=Ka/c(CH3COO-),醋酸根离子浓度减小,电离常数不变,则比值增大,正确;B、0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后得到等浓度的醋酸钠和醋酸的混合液,溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,醋酸的电离是微弱的,所以醋酸的浓度大于氢离子浓度,则c(CH3COO-)>c(Cl-)> c(CH3COOH)> c(H+),错误;C、pH=4的醋酸中氢离子浓度与pH=10的氢氧化钠溶液中氢氧根离子的浓度相等,醋酸是弱酸,所以醋酸溶液的浓度大于氢氧化钠溶液的浓度,等体积混合,则醋酸过量,溶液的pH<7,正确;D、酸溶液中的氢氧根离子来自水的电离,Kw=1×10-14,所以![]() =1×10-8时,则c(OH-)=1×10-11mol/L,水电离产生的氢离子与氢氧根离子浓度相等,所以该溶液中由水电离出的c(H+)=1×10-11mol·L-1
=1×10-8时,则c(OH-)=1×10-11mol/L,水电离产生的氢离子与氢氧根离子浓度相等,所以该溶液中由水电离出的c(H+)=1×10-11mol·L-1


科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)以CO2与NH3为原料可合成尿素[CO(NH2)2]。已知:
①2NH3(g) + CO2(g) === NH2COONH4(s) △H=-159.47 kJ·mol-1
②NH2COONH4(s) === CO(NH2)2(s) + H2O(g) △H=+116.49 kJ·mol-1
③H2O(l) === H2O(g) △H=+88.0 kJ·mol-1
写出NH3和CO2合成尿素和液态水的热化学方程式_____________。
(2)海洋是地球上碳元素的最大“吸收池”。
①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________、_________。
②在海洋碳循环中,可通过右图所示的途径固碳。写出钙化作用的离子方程式_____________。
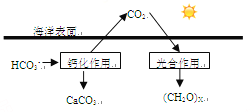
(3)常温常压下,空气中的CO2溶于水中达到平衡时,其转化关系如下:
①CO2 + H2O![]() H2CO3 K=1.8×10-3
H2CO3 K=1.8×10-3
②H2CO3![]() H++HCO3- K a 1=4.3×10-7,
H++HCO3- K a 1=4.3×10-7,
③HCO3-![]() H++CO32- K a2=5.6×10-11,
H++CO32- K a2=5.6×10-11,
通常情况下,海水的pH约为8,若忽略水的电离及H2CO3的第二级电离,则溶液中c(CO2)=____ mol/L。(保留两位有效数字)
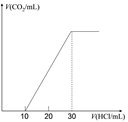
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用 N2吹出CO2,再用NaOH溶液吸收。用1.0mol/L盐酸滴定吸收液,生成的V(CO2)随V(盐酸) 变化关系如左图所示,则吸收液中离子浓度由大到小的顺序为______,湖水中无机碳的浓度为___mol/L。
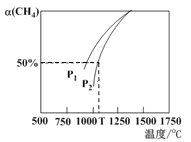
(5)用CO2和天然气可以制备CO和H2,CO2(g) +CH4(g) ![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0. 1 mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如右图所示,则压强P1 ____P2(填“>”或“<”)。若P2= 3MPa,则T°C时该反应的平衡常数 Kp =_____MPa2
2CO(g)+2H2(g)。密闭容器中浓度均为0. 1 mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如右图所示,则压强P1 ____P2(填“>”或“<”)。若P2= 3MPa,则T°C时该反应的平衡常数 Kp =_____MPa2
(用平衡分压代替平衡浓度计算, 分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计与对应结论正确的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 能证明Al(OH)3不溶于氨水 | 能证明非金属性:Cl>C>Si | 验证铁发生析氢腐蚀 | 洗气瓶中产生的白色沉淀是BaSO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定环境下能大量共存的是 ( )
A.pH=7的溶液中Al3+、Cl-、SO![]() 、HCO
、HCO![]()
B.由水电离出来的c(H+)=10-12mol/L的溶液中Na+、HCO![]() 、SO
、SO![]() 、K+
、K+
C.pH=0的溶液中Na+、K+、Fe2+、ClO-
D.c(OH-)=10-2mol/L的溶液中S2-、SO![]() 、S2O
、S2O![]() 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.Cu和HNO3 C.N2和O2 D.Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物由两种单质直接反应生成,将其加入足量Ba(OH)2溶液中有沉淀产生。下列物质符合上述条件的是( )
A. AlCl3 B. Na2O C. FeCl2 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.  和
和 是两种不同的物质
是两种不同的物质
B. 二氯甲烷属于正四面体的空间结构
C. 己烷(C6H14)有5种同分异构体
D. 新戊烷与2, 2—二甲基丙烷的结构不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸的结构简式为![]() ,
,
(1)将水杨酸与______________溶液作用,可以生成![]() ;请写出将
;请写出将 ![]() 转化为
转化为![]() 的化学方程式_______________。
的化学方程式_______________。
(2)写出同时符合下列条件的水杨酸的同分异构体:________________
①能发生银镜反应 ②能与氯化铁溶液显色
③核磁共振氢谱1:2:2:1 ④能够水解
(3)水杨酸与乙酸酐作用可得阿司匹林,阿司匹林是一种常用的解热镇痛药,其结构如图: ,它与足量氢氧化钠溶液发生反应的方程式
,它与足量氢氧化钠溶液发生反应的方程式
是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com