
| A. | HSO4- | B. | Cl- | C. | 13X3+ | D. | 16X2- |
分析 A.硫酸氢根离子在水中能电离出氢离子;
B.氯离子是强酸的阴离子不水解;
C.该微粒为Al3+;
D.该微粒为S2-.
解答 解:水的电离H2O?H++OH-,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离.
A.硫酸氢根离子在水溶液中完全电离,电离出氢离子和硫酸根离子,水的电离H2O?H++OH-,抑制了水的电离,水的电离向逆反应方向移动,故A正确;
B.盐酸为强酸,氯离子为盐酸的阴离子,为强酸根,不水解,对水的电离无影响,故B错误;
C.Al3+为弱碱阳离子,在溶液中会水解,使水的电离平衡右移,故C错误;
D.该微粒为S2-,S2-为弱酸根,在溶液中会水解,使水的电离平衡右移,故D错误.
故选A.
点评 本题主要考查了水的电离平衡的移动,解答须抓住酸或碱抑制水的电离,加入能水解的盐促进水的电离,题目不难.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后消失 | |
| B. | 块状生石灰在空气中逐渐变成粉末;晶体碳酸钠在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 乙醇的结构式为: | |
| C. | 用电子式表示Na2S的形成过程可表示为: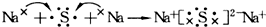 | |
| D. | 丙烷的比例模型为: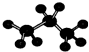 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 溶度积小的沉淀可以转化为溶度积更小的沉淀 | |
| B. | 若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 | |
| C. | 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 | |
| D. | 25℃时,AgCl固体在等质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.
探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.
用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7 | B. | c(A-)>c(B+) | ||
| C. | c(OH-)=$\sqrt{{K}_{w}}$ | D. | c(H+)-c(OH-)=c(A-)-c(B+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中的N-H键数目为6NA | |
| B. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| C. | 100 g 98%的浓硫酸中含氧原子个数为4NA | |
| D. | 1 L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com