
1)某化学反应的反应物和产物如下:
Al+NaNO3+H2O→Al(OH)3+N2↑+NaAlO2
a、该反应的氧化剂是 NaNO3 .
b、该反应的氧化产物是 Al(OH)3、NaAlO2 .
C、反应过程中转移5mol e﹣,生成标准状况下N2的体积为 11.2 L.
d、配平该氧化还原反应
10 Al+ 6 NaNO3+ 6 H2O═ 4 Al(OH)3+ 3 N2↑+ 6 NaAlO2
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的离子方程式为 Fe+2H+=Fe2++H2↑ .
| 氧化还原反应;氧化还原反应方程式的配平.. | |
| 专题: | 氧化还原反应专题. |
| 分析: | (1)Al+NaNO3+H2O→Al(OH)3+N2↑+NaAlO2中,Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,结合电子守恒及原子守恒分析; (2)铁粉在人体胃酸中发生反应生成亚铁离子和氢气. |
| 解答: | 解:(1)Al+NaNO3+H2O→Al(OH)3+N2↑+NaAlO2中,Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0, a、N元素的化合价降低,则NaNO3为氧化剂,故答案为:NaNO3; b、Al元素的化合价升高,被氧化,则氧化产物为Al(OH)3、NaAlO2,故答案为:Al(OH)3、NaAlO2; c、由N元素的化合价变化可知,生成1mol氮气转移10mol电子,则转移5mol e﹣,生成标准状况下N2的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2; d、Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,转移30mol电子时,Al的化学计量数为10,NaNO3的化学计量数为6,由电子守恒及原子守恒可知,该反应为10Al+6NaNO3+6H2O=4Al(OH)3+3N2↑+6NaAlO2,故答案为:10;6;6;4;3;6; (2)铁粉在人体胃酸中发生反应生成亚铁离子和氢气,离子反应为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑. |
| 点评: | 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、配平及转移电子的考查,综合性较强,题目难度不大. |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)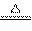 CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属元素特征的叙述正确的是( )
|
| A. | 金属元素的原子只有还原性,其阳离子只有氧化性 |
|
| B. | 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强 |
|
| C. | 钠元素在自然界中以化合态存在 |
|
| D. | 金属元素的单质在常温下都为固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同条件下,相同浓度的盐酸分别与镁、铝、铁3种金属恰好完全反应,产生相同体积的氢气(相同状况下),则下列说法正确的是( )
|
| A. | 开始时,产生氢气的速率相同 |
|
| B. | 参加反应的金属的质量相同 |
|
| C. | 所得溶液的质量相等 |
|
| D. | 参加反应的金属的质量比为12:9:28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O→Y+H2;Z+H2O→W+O2 (方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
|
| A. | X>Y、Z>W | B. | X<Y、Z<W | C. | X>Y、Z<W | D. | X<Y、Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
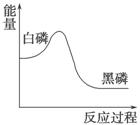
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示。下列叙述中正确的是
A.黑磷比白磷稳定 B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
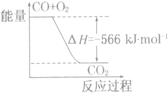
已知:2CO(g)+O2(g)=2CO2 (g) △H= -566 kJ.mol-1
 Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g) △H= -226 kJ.mol-1
Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g) △H= -226 kJ.mol-1
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H= - 452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2x6.02×l023
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C8H10O的芳香族化合物,遇三氯化铁溶液不显色,能与金属钠反应放出氢气,
满足条件的同分异构体有
A.4种 B.5种 C.10种 D.大于10种
查看答案和解析>>
科目:高中化学 来源: 题型:
将15%的NaOH溶液蒸发掉100 g水后得到125 ml质量分数为30%的NaOH溶液,则此时溶液的物质的量浓度为( )
A.6 mol·L-1 B.6.25 mol·L-1 C.6.75 mol·L-1 D.7 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com