
【题目】某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略)。
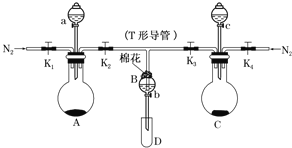
(1)按图连接好装置,检查A装置的气密性的方法为___。
(2)检查完装置的气密性,添加药品,向A装置的分液漏斗中加入浓盐酸,在圆底烧瓶中加入固体KMnO4;向B装置中加入10mLFeCl2溶液;在C装置的分液漏斗中加入70%的硫酸,向圆底烧瓶中加入固体Na2SO3;棉花浸润___溶液。打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1,K3,K4。通入一段时间N2的目的是___。
(3)打开活塞a,逐滴加入浓盐酸,当B中溶液变为棕黄色时,停止滴加浓盐酸,夹紧K2,打开活塞b,使约2mL的溶液流入D试管中,分别取1mL溶液滴入___(填试剂名称)和铁氰化钾溶液可以证明其中含有Fe3+和Fe2+。A装置中发生反应的离子方程式为___。
(4)打开K3和活塞c,逐滴加入70%的硫酸,当B中溶液颜色逐渐变为___色,停止滴加70%的硫酸,夹紧K3,打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子。B中发生反应的离子方程式为___。
(5)结合实验现象判断Fe3+、Cl2、SO2氧化性由弱到强的顺序为___。
【答案】关闭a、b、K1、K3,打开K2,向B装置中加水,将T形导管下端插入水中,微热A装置,看到有气泡产生,停止加热恢复室温,T形导管下端形成一段水柱,说明A装置气密性良好 NaOH 排出装置中的空气,防止其干扰实验 硫氰化钾 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 浅绿 SO2+2Fe3++2H2O=2Fe2++SO42-+4H+ SO2<Fe3+<Cl2
【解析】
(1)检查装置气密性,首先要密闭,应关闭a、b、K1、K3,打开K2,向B装置中加水,T形导管下端插入水中,微热A装置,看到有气泡产生,停止加热恢复室温,T形导管下端形成一段水柱,说明A装置气密性良好;
(2)用碱溶液为尾气处理装置;通入一段时间N2的目的是排出装置中的空气;
(3)Fe3+遇KSCN溶液变为血红色;A装置中酸性条件下高锰酸根离子将氯离子氧化成氯气;
(4)Fe3+被SO2还原为Fe2+;B中二氧化硫被铁离子氧化成硫酸;
(5)根据方程式,氧化剂的氧化性大于氧化产物。
(1)检查装置气密性,首先要密闭,应关闭a、b、K1、K3,打开K2,向B装置中加水,T形导管下端插入水中,微热A装置,看到有气泡产生,停止加热恢复室温,T形导管下端形成一段水柱,说明A装置气密性良好;
(2)用碱溶液吸收多余的氯气、二氧化硫,防止污染空气;通入一段时间N2的目的是排出装置中的空气,防止其干扰实验;
(3)氯气将氯化亚铁中的Fe2+氧化为Fe3+,Fe3+遇KSCN溶液变为血红色,则用硫氰化钾可以证明其中含有Fe3+;A装置中酸性条件下高锰酸根离子将氯离子氧化成氯气,反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(4)Fe3+被SO2还原为Fe2+,溶液变为浅绿色;B中二氧化硫被铁离子氧化成硫酸,反应的离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;
(5)结合实验现象及氧化还原反应原理可知:Cl2、Fe3+和SO2的氧化性由弱到强的顺序为:SO2<Fe3+<Cl2。


科目:高中化学 来源: 题型:
【题目】绿原酸(见右图)是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法正确的是( )

A.绿原酸的分子式为C16H20O9
B.绿原酸既能和溴水发生加成反应,又能发生取代反应
C.1 mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH
D.咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,若t1时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是()
C+D,若t1时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是()
A.A、B、C是气体,D不是气体B.C、D是气体,A、B有一种是气体
C.C、D有一种是气体,A、B都不是气体D.A、B是气体,C、D有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来,其装置如图乙所示,ab间充有固体电解质Y2O3-Na2O,允许O2-自由移动。下列叙述正确的是
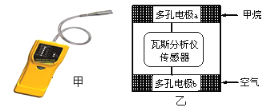
A.瓦斯分析仪工作时,电池内电路中, O2-由电极a流向电极b
B.电池外电路中电子由正极流向负极
C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,N2(g)+3H2(g) ![]() 2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
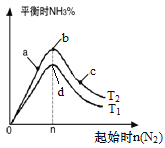
A.图中T2和T1的关系是:T2<T1
B.在a、b、c三点所处的平衡状态中,反应物H2的转化率最高的是b
C.在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大
D.反应体系中活化分子的百分含量d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =____mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量_____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =______;
(4)原混合气体中,a∶b =_____;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= ______;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
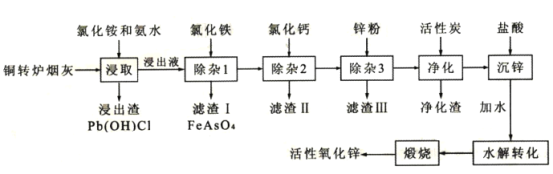
己知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
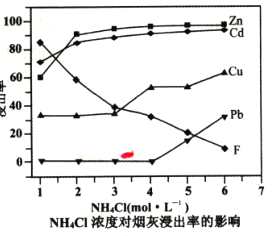
(2)在反应温度为50℃,反应时间为lh时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,结合流程图分析,氯化铵适宜的浓度为___ mo1·L-1。
(3)若浸出液中c(AsO43-)=6.0×10-3molL-1,现将8.0×10-3mo1L-1FeC13溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22,则反应后溶液中c(AsO43-)=___mo1L-1。
(4)滤渣II的主要成分为___;除杂3是置换除杂过程,则此过程主要除去的金属有___(填化学式)。
(5)沉锌得到的物质为Zn(NH3)2C12,请写出水解转化的化学方程式___。
(6)该流程中可以循环使用的物质的电子式为___。
(7)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A.SiF4和 CO![]() 的中心原子均为sp3杂化
的中心原子均为sp3杂化
B.![]() 此图错误,违背了泡利原理
此图错误,违背了泡利原理
C.凡中心原子采取sp3 杂化的分子,其 VSEPR 模型都是四面体
D.SO2为 V 形的极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )
![]()
A. 若甲是AlCl3溶液,则丁可能是NaOH溶液
B. 若甲是Fe,则丁可能是Cl2
C. 若丁是CO2,则甲可能为Mg
D. 若丁是O2,则乙、丙的相对分子质量可能相差16
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com