
【题目】氨的合成对国家工业发展有着举足轻重的作用,N2(g)+3H2(g) ![]() 2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
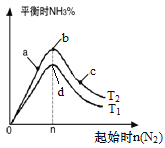
A.图中T2和T1的关系是:T2<T1
B.在a、b、c三点所处的平衡状态中,反应物H2的转化率最高的是b
C.在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大
D.反应体系中活化分子的百分含量d>b
【答案】B
【解析】
A. N2(g)+3H2(g) ![]() 2NH3(g) △H<0,为放热反应,升高温度,反应逆向移动,氨气的百分含量减小,则图中 T2和 T1的关系是: T2<T1,故A正确;
2NH3(g) △H<0,为放热反应,升高温度,反应逆向移动,氨气的百分含量减小,则图中 T2和 T1的关系是: T2<T1,故A正确;
B. 在a、b、c三点所处的平衡状态中,c点反应物 N2的物质的量比a、b点大,反应正向移动,氢气的转化率最高,故B错误;
C. 根据反应物的物质的量之比等于化学计量数之比时,达到平衡状态时生成物的百分含量最大,在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大,故C正确;
D. b和d点氮气的起始物质的量相同,平衡时b点氨气的百分含量比d点大, 由于T2<T1,温度越高,活化分子的百分数越高,则反应体系中活化分子的百分含量d>b,故D正确;
答案选B。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
(方案l)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)图中球形干燥管的作用是__________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_____________。
(3)假设其他操作均正确,按照图装置将导致测定结果_______________(填“偏高”、“偏低”或“无影响”)。
(方案2)用图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
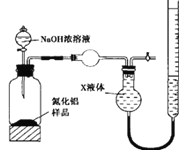
(4)为测定生成气体的体积,量气装置中的X液体最好选择________________。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.浓硫酸
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况)。则AlN的质量分数是___________________(需化简)。
(方案3)按下列路径测定样品中AlN的纯度:

(6)写出步骤反应的离子方程式_____________________。
(7)该方案能否测出AlN的纯度?(若能请用m1,m2列出计算纯度的表达式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() △H=+802kJ/mol,如图为在恒温、光照、不同初始浓度和不同催化剂
△H=+802kJ/mol,如图为在恒温、光照、不同初始浓度和不同催化剂![]() Ⅰ、Ⅱ
Ⅰ、Ⅱ![]() 作用下,体积为2L的密闭容器中
作用下,体积为2L的密闭容器中![]() 随光照时间的变化曲线。根据所给信息可得出的结论
随光照时间的变化曲线。根据所给信息可得出的结论

A.对于Ⅰ,![]() ,υ(H2O)=0.015mol mol·L-1·h-1
,υ(H2O)=0.015mol mol·L-1·h-1
B.![]() ,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
C.![]() ,使用催化剂Ⅰ吸出的热量多于催化剂Ⅱ
,使用催化剂Ⅰ吸出的热量多于催化剂Ⅱ
D.a点时,二氧化碳的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
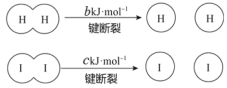
A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R’CH2Cl![]() RNHCH2R’+HCl(R和R’代表烃基)
RNHCH2R’+HCl(R和R’代表烃基)
②苯的同系物能被高锰酸钾氧化,如:![]()
![]()
![]()
③![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
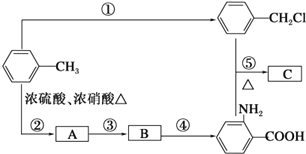
请回答下列问题:
(1)B物质的结构简式是 ______。
(2)写出反应①、②的化学方程式:
①______________;
②______________。
(3)反应①~⑤中,属于取代反应的是______(填反应序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略)。
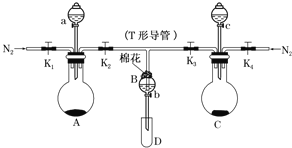
(1)按图连接好装置,检查A装置的气密性的方法为___。
(2)检查完装置的气密性,添加药品,向A装置的分液漏斗中加入浓盐酸,在圆底烧瓶中加入固体KMnO4;向B装置中加入10mLFeCl2溶液;在C装置的分液漏斗中加入70%的硫酸,向圆底烧瓶中加入固体Na2SO3;棉花浸润___溶液。打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1,K3,K4。通入一段时间N2的目的是___。
(3)打开活塞a,逐滴加入浓盐酸,当B中溶液变为棕黄色时,停止滴加浓盐酸,夹紧K2,打开活塞b,使约2mL的溶液流入D试管中,分别取1mL溶液滴入___(填试剂名称)和铁氰化钾溶液可以证明其中含有Fe3+和Fe2+。A装置中发生反应的离子方程式为___。
(4)打开K3和活塞c,逐滴加入70%的硫酸,当B中溶液颜色逐渐变为___色,停止滴加70%的硫酸,夹紧K3,打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子。B中发生反应的离子方程式为___。
(5)结合实验现象判断Fe3+、Cl2、SO2氧化性由弱到强的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
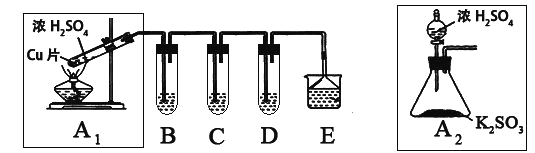
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________________________________________________________________ | _____________________ |
步骤3____________________________________________ | _________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定环境中一定能大量共存的是( )
A.使pH试纸显蓝色的溶液中:Cu2+、NO![]() 、Fe3+、SO
、Fe3+、SO![]()
B.与铝粉反应放出氢气的无色溶液中:NO![]() 、Al3+、Na+、SO
、Al3+、Na+、SO![]()
C.pH=0的溶液中:Al3+、NH![]() 、Ca2+、ClO-
、Ca2+、ClO-
D.使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为______________,P的基态原子价层电子排布式为__________________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为___________________。
(3)M、O电负性大小顺序是__________(用元素符号表示),实验室制备O单质的化学方程式__________________________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的边长为 a pm,则该晶体的密度为____________________g/cm3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com