
【题目】SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
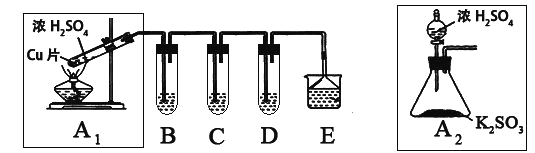
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________________________________________________________________ | _____________________ |
步骤3____________________________________________ | _________________________ |
【答案】品红溶液 SO2+ I2+ 2H2O = SO42-+2I-+ 4H+ 不用加热,安全性能高;易于控制反应进行,反应更充分。 滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 若品红褪色(或有气泡),则“吸收液”中存在 SO32-。 用试管取适量滤液(1分),向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液 [或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-。
【解析】
由题中信息可知,A装置是制备二氧化硫的装置,B、C、D分别用于检验SO2的漂白性、还原性和氧化性,E装置是尾气处理装置。亚硫酸钡不溶于水,而亚硫酸氢钡可溶于水。在沉淀中检验亚硫根离子,在滤液中检验亚硫酸氢根离子。
(1)根据C和D中的试剂可知,碘水是检验SO2的还原性的,而H2S是检验SO2的氧化性的,所以装置B是检验SO2的漂白性的,盛放的试剂是品红溶液。碘水氧化SO2的离子方程式是SO2+ I2+ 2H2O = SO42-+2I-+ 4H+。
(2)根据装置的特点可判断,和装置A相比,其优点是①不用加热,安全性能高。②易于控制反应进行,反应更充分。
(3)由于亚磷酸盐能和和盐酸反应生成SO2,而SO2可以使品红溶液褪色,据此可以检验SO32-;亚硫酸氢盐一般易溶于水,滤液中有过量的氯化钡存在,所以如果滤液中加入氢氧化钡能生成白色沉淀,即能证明溶液中含有HSO3-。所以正确的操作是:
实验操作 | 预期现象与结论 |
步骤2:滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡),则“吸收液”中存在 SO32-。 |
步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液 [或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡。 | 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-。 |


科目:高中化学 来源: 题型:
【题目】模拟电渗析法淡化海水的工作原理示意图如下。已知X、Y均为惰性电极,模拟海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子。下列叙述不正确的是( )
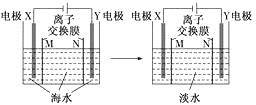
A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为2H2O-4e-=4H++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸苄酯又名苯丙烯酸苄酯,常作为定香剂,可用于香皂及食品香精的调香原料。以下是一种合成肉桂酸苄酯的路线。
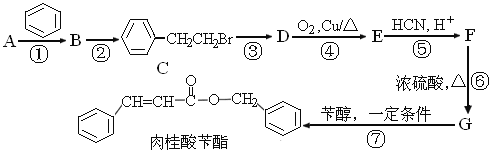
已知:I.相同条件下,烃A对氢气的相对密度为13
Ⅱ.反应①、反应②的原子利用率均为100%
III.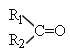
![]()
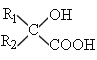
回答下列问题:
(1)A的结构简式为________,G中的官能团的名称是____________。
(2)反应③的条件为_______。上述合成路线①~⑦步涉及的反应中,属于取代反应的有__________(填编号)。
(3)写出反应D→E的化学方程式___________________________。
(4)F同时满足下列条件的同分异构体共有_________种(不考虑立体异构)。
①苯环上有2个取代基
②能发生银镜反应和水解反应
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示6组峰,且峰面积比为3 :2: 2:1:1:1的是___________(填结构简式)。
(5)参照上述合成路线,以CH3CHO为原料,设计制备![]() 的合成线路(无机试剂及溶剂任选)_____________________________。
的合成线路(无机试剂及溶剂任选)_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,N2(g)+3H2(g) ![]() 2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
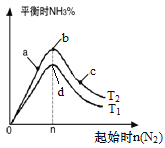
A.图中T2和T1的关系是:T2<T1
B.在a、b、c三点所处的平衡状态中,反应物H2的转化率最高的是b
C.在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大
D.反应体系中活化分子的百分含量d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水是弱电解质,电离方程式为H2O+H2O![]() H3O++OH-
H3O++OH-
B.常温下,向水中加入H2SO4溶液,H+ 浓度增大,Kw增大
C.将纯水加热到100℃,pH≈6,显酸性
D.常温下,将0.1mol·L-1的 NaOH溶液体积稀释到原来的10倍,则pH=12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
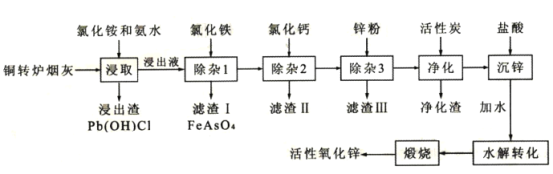
己知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
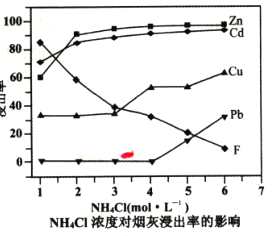
(2)在反应温度为50℃,反应时间为lh时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,结合流程图分析,氯化铵适宜的浓度为___ mo1·L-1。
(3)若浸出液中c(AsO43-)=6.0×10-3molL-1,现将8.0×10-3mo1L-1FeC13溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22,则反应后溶液中c(AsO43-)=___mo1L-1。
(4)滤渣II的主要成分为___;除杂3是置换除杂过程,则此过程主要除去的金属有___(填化学式)。
(5)沉锌得到的物质为Zn(NH3)2C12,请写出水解转化的化学方程式___。
(6)该流程中可以循环使用的物质的电子式为___。
(7)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下,则下列说法不正确的是
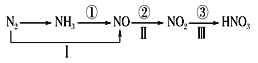
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】遵义市某些地区出现了不同程度的雾霾天气,我校课题小组的同学对其进行了调查研究,
Ⅰ.课题小组研究发现,其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。
(1)25℃时将PM2.5样本用蒸馏水处理制成待测溶液。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
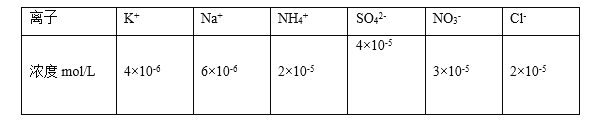
根据表中数据判断试样的pH=________。
Ⅱ.课题组就其酸性物质做进一步研究
一氧化氮、二氧化氮的研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:
2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
A.混合气体的密度保持不变 B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变 D.O2的消耗速率和NO2的消耗速率相等
(2)活性炭可处理大气污染物NO,反应原理为:C(s)+2NO(g)![]() N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
III.一氧化碳、二氧化碳的研究
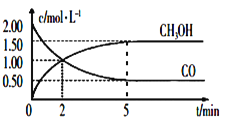
(1)CO或CO2在一定条件下可以用来合成甲醇。工业上常用CO和H2制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △ H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △ H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △ H= - 178.3kJ/mol
①计算反应Ⅳ:C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______kJ/mol;
CaCO3(s)+2H2(g)的△H=______kJ/mol;
对硫的氧化物的研究
②SO2可被Na2FeO4氧化而去除污染,工业上用Fe和石墨作电极电解浓NaOH溶液制备Na2FeO4。写出电解过程中阳极发生的电极反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国对环境问题的重视,碳、氮及其化合物的研究备受关注。
已知:Ⅰ![]()
![]() ;
;
Ⅱ![]()
![]() ;
;
Ⅲ![]()
![]()
![]() .
.
请回答下列问题:
(1)![]() ________。
________。
(2)一定温度下,向刚性容器中充入![]() 和足量
和足量![]() ,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。
,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。
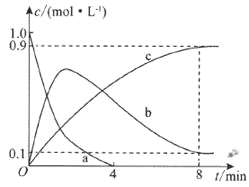
![]() 已知曲线a代表
已知曲线a代表![]() 的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
![]() 该刚性容器的容积为________;
该刚性容器的容积为________;![]() 内,
内,![]() 的消耗速率
的消耗速率![]() ________。
________。
![]() 该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________
该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________![]() 填“反应Ⅰ”或“反应Ⅱ”
填“反应Ⅰ”或“反应Ⅱ”![]() ,原因为________。
,原因为________。
![]() 该温度下,反应Ⅲ的化学平衡常数
该温度下,反应Ⅲ的化学平衡常数![]() Ⅲ
Ⅲ![]() ________。
________。
(3)若其他条件不变,将恒温容器改为绝热容器,再次达到平衡后,与原平衡相比,CO的体积分数________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() ,原因为________。
,原因为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com