
【题目】NO、NO2是大气污染物,但只要合理利用也是重要的资源。
(1)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入-密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图1所示,则条件X可能是________(填字母)。
2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图1所示,则条件X可能是________(填字母)。
a 温度 b 压强 c ![]() d 与催化剂的接触面积
d 与催化剂的接触面积
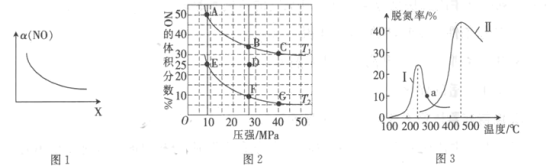
(2)在密闭容器中充入4 mol CO和5 mol NO,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1=-746.5 kJ· mol-1,图2为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H1=-746.5 kJ· mol-1,图2为平衡时NO的体积分数与温度、压强的关系曲线图。
①温度:T1_______(填“<”或“>”)T2。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,重新达到平衡,则D点应向图中A~G点中的_______点移动。
③某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图3所示。温度低于200℃时,图3中曲线I脱氮率随温度升高而变化不大的主要原因为____________;a点_______(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由:__________。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法处理燃煤烟气中的NO,装置如图4所示:
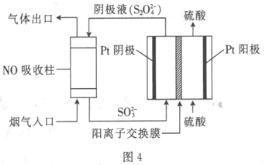
①阴极区的电极反应式为_______________。
②NO被吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上被吸收的NO在标准状况下的体积为____________mL。
【答案】ac > A 温度较低时,催化剂的活性偏低 不是 催化剂不改变转化率且该反应为放热反应,因此根据曲线Ⅱ可知,a点对应温度的平衡脱氮率会更高 2SO32-+4H++2e-=S2O42-+2H2O 1344
【解析】
(1)根据图像,可知随着X的增大,NO的转化率降低;
a温度升高,平衡向吸热反应方向移动,△H<0,正反应为放热反应,则升高温度,平衡逆向移动,a符合题意;
b增大压强,平衡向着气体体积减小的反应移动,正反应方向为气体体积减小的方向,则增大压强,向正反应方向移动,b不符合题意;
c![]() 越来越大,则NO的量越多,增大NO的量,Cl2的转化率增大,而NO的转化率减小,c符合题意;
越来越大,则NO的量越多,增大NO的量,Cl2的转化率增大,而NO的转化率减小,c符合题意;
d催化剂不改变平衡,因此NO转化率不变,d不符合题意;
答案为ac;
(2) ①当压强相同时,温度为T1时,NO体积分数更大;该反应是放热反应,升高温度,平衡逆向移动,NO的体积分数变大,则T1>T2;
②对反应进行升温且同时扩大容器体积使平衡压强减小,压强减小,D点向左移动,升高温度,D点向上移动,则D点向左上方移动,A点在D点的左上方,则D点向图中A点移动;
③从图中可知,曲线Ⅰ在250℃时,脱氮率最高,温度低于200℃,脱氮率低,说明化学反应速率慢,催化剂的活性低;催化剂不改变平衡移动,a点的脱氮率在曲线中不是最高的点,说明并没有达到平衡,答案为温度较低时,催化剂的活性偏低 不是 催化剂不改变转化率且该反应为放热反应,因此根据曲线Ⅱ可知,a点对应温度的平衡脱氮率会更高;
(3) ①根据图示,SO32-变成了S2O42-,电解质溶液会酸性,则电极反应式为2SO32-+4H++2e-=S2O42-+2H2O;
②NO被吸收转化后的主要产物为NH4+,化合价从+2降低到-3,则1molNO转移5mol电子,现转移了0.3 mol e-,则NO的物质的量为![]() ,则体积为0.06mol×22.4L·mol-1=1.344L=1344mL。
,则体积为0.06mol×22.4L·mol-1=1.344L=1344mL。


科目:高中化学 来源: 题型:
【题目】原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数 B. X、Y的核电荷数之差是(m-n)
C. X和Y处于同一周期 D. Y元素与X元素的族序数之差是8-(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图甲,C的百分含量与温度的关系如图乙。
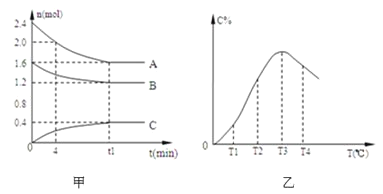
下列分析不正确的是( )
A.0~4 min时,A的平均反应速率为0.02 mol·L-1·min-1
B.该反应的化学方程式为2A(g)+B(g)C(g)
C.由T1向T2变化时,正反应速率大于逆反应速率
D.该反应正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mLNaOH溶液中逐滴加入![]() 醋酸溶液,滴定曲线如图所示。下列判断正确的是
醋酸溶液,滴定曲线如图所示。下列判断正确的是
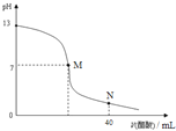
A.在M点,两者恰好反应完全
B.滴定前,酸中![]() 等于碱中
等于碱中![]()
C.NaOH溶液的物质的量浓度为![]()
![]()
D.在N点,c(CH3COO-)> c(Na+)>c(H+)> c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2mol水的摩尔质量和1mol水的摩尔质量
B.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
C.64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数g
D.200mL1mol/L氯化钙溶液中c(Cl-)和200mL1mol/L氯化钾溶液中c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置的叙述正确的是( )
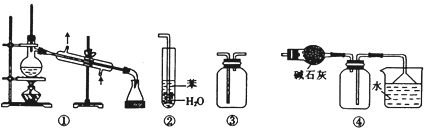
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②用于吸收NH3或HCl气体时,易形成倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3、C2H4等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下框图分析,下列说法正确的是
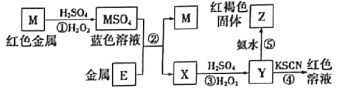
A.E2+的氧化性比M2+的氧化性强
B.在反应③中若不加稀硫酸可能看到红褐色沉淀
C.反应⑤的离子方程式可表示为E2++3OH-=E(OH)3↓
D.在反应①中只能用浓硫酸,既表现酸性,又表现了氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数值用NA表示,下列说法正确的是( )
A.常温下1LpH=3的亚硫酸溶液中,含H+数目为0.3NA
B.A1与NaOH溶液反应产生11.2L气体,转移的电子数为0.5NA
C.NO2与N2O4混合气体的质量共ag,其中含质子数为0.5aNA
D.1mo1KHCO3晶体中,阴阳离子数之和为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com