
【题目】我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
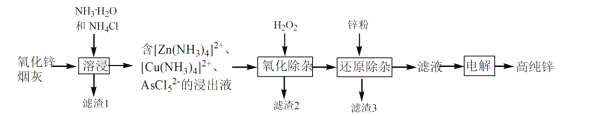
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的____ 性。
(2)滤渣1和滤渣3的主要成份分别是______、______(填化学式)。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是______;“溶浸”时温度不宜过高,其原因是______。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是______。
(5)“电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是______。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_____(写化学式)。该流程中可以循环使用的物质是_____(写化学式)。
【答案】还原 Pb Cu ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3H2O +2NH4+=[Zn(NH3)4]2++3H2O 避免氨水的分解与挥发 2AsCl52-+2H2O2+H2O=As2O5(胶体)+1OCl-+6H+ [Zn(NH3)4]2++2e-= Zn+4NH3↑ N2 NH4Cl(或NH3H2O和NH4Cl)
【解析】
(1)《天工开物》中炼锌,发生的氧化还原反应为2ZnO+C![]() 2Zn+CO2↑。
2Zn+CO2↑。
(2)根据流程可知氧化锌烟灰中Zn,Cu,As三种元素都形成配合物了,故滤渣1为Pb,加入锌粉把铜置换出来,故滤渣3为Cu。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3 H2O +2NH4+=[Zn(NH3)4]2++3H2O;氨水受热易挥发和分解,故“溶浸”时温度不宜过高。
(4)H2O2具有氧化性,把AsCl52-转化为As2O5胶体。
(5)[Zn(NH3)4]2+在阴极得电子被还原,放电的电极反应式是[Zn(NH3)4]2++2e-= Zn+4NH3↑,
阳极区氯离子放电生成氯气,氯气把氨氧化生成了氮气。
(1)《天工开物》中炼锌,发生的氧化还原反应为2ZnO+C![]() 2Zn+CO2↑,利用了木炭的还原性,故答案为:还原。
2Zn+CO2↑,利用了木炭的还原性,故答案为:还原。
(2)根据流程可知氧化锌烟灰中Zn,Cu,As三种元素都形成配合物了,故滤渣1为Pb,加入锌粉把铜置换出来,故滤渣3为Cu,故答案为:Pb,Cu。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3 H2O +2NH4+=[Zn(NH3)4]2++3H2O;氨水受热易挥发和分解,故“溶浸”时温度不宜过高,故答案为:ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3 H2O +2NH4+=[Zn(NH3)4]2++3H2O;避免氨水的分解与挥发。
(4)H2O2具有氧化性,把AsCl52-转化为As2O5胶体,反应的离子方程式为2AsCl52-+2H2O2+H2O=As2O5(胶体)+1OCl-+6H+,故答案为:2AsCl52-+2H2O2+H2O=As2O5(胶体)+1OCl-+6H+。
(5)[Zn(NH3)4]2+在阴极得电子被还原,放电的电极反应式是[Zn(NH3)4]2++2e-= Zn+4NH3↑,
阳极区氯离子放电生成氯气,氯气把氨氧化生成了氮气,该流程中可以循环使用的物质是NH4Cl(或NH3H2O和NH4Cl),故答案为:[Zn(NH3)4]2++2e-= Zn+4NH3↑;N2;NH4Cl(或NH3H2O和NH4Cl)。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】把氢氧化钙放入蒸馏水中,一定时间后达到下列溶解平衡:Ca(OH)2 (s) ![]() Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
A. CaCl2 B. NaHCO3 C. NaOH D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】口服抗菌药利君沙的制备原料E和某种广泛应用于电子电器领域的高分子化合物H的合成路线如下:
已知:

I、核磁共振氢谱显示E分子中有两组峰,且峰面积比为2:1
Ⅱ、![]()
![]()
![]()
Ⅲ、
回答下列问题:
(1)丙烯的结构简式为_______________;E的分子式为_____________________;
(2)B分子中官能团的名称为__________________;G的名称为_______________________。
(3)由甲苯生成F的反应类型为_________________。
(4)写出C→D的化学方程式________________________________________________。
(5)满足下列条件的G的同分异构体有_________种。
①苯环上有三个取代基。②遇![]() 溶液发生显色反应。
溶液发生显色反应。
③能和![]() 溶液反应生成
溶液反应生成![]() 。
。
(6)写出1,3-丁二烯(![]() )和乙二醇(
)和乙二醇(![]() )为某原料制备聚酯纤维
)为某原料制备聚酯纤维 的合成路线________________(无机试剂任选)。
的合成路线________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 1L 1mol/L CH3COONa 溶液中含有 CH3COO-的数目为 NA
B. 100 ml 1.0 mol·L-1 FeCl3 溶液与足量 Cu 反应,转移的电子数为 0.2NA
C. 标准状况下,11.2 L CCl4 中含有 C—Cl 键的数目为 2NA
D. NA 个 D2O 分子中,含有 10NA 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要配制500 mL 1 mol·L-1硫酸溶液。
(1)需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸________mL。
有如下操作步骤:
①把量好的浓硫酸沿烧杯壁慢慢注入蒸馏水中,并用玻璃棒搅拌溶解。
②把①所得溶液冷却后小心转入500mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(2)操作步骤的正确顺序为______________(填序号)。
(3)本实验必须用到的玻璃仪器有10ml量筒、玻璃棒、烧杯、_________。
(4)下列情况使所配溶液的浓度偏高的是_________
A.某同学观察液面的情况如图所示

B.没有进行操作步骤④;
C.加蒸馏水时不慎超过了刻度线,再吸出一部分水。
D.向容量瓶中转移溶液时(操作步骤②)溶液流到容量瓶外面
(5)若实验过程中出现(4)中D选项情况应如何处理?:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:

已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为__________。
(2)滤渣1的化学式为__________________。
(3)流程中“氧化”的氧化剂是:_________,写出该流程的离子方程式为______________。
(4)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。

①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com