
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
【答案】D
【解析】
A.锂电池中锂为电池的负极,失电子生成锂离子,反应式:Li -e-= Li+;
B.放电时的总反应式为电池正负极得失电子总数相等时电极反应相加;
C.锂电极为电池的负极,负极的电势比正极低;
D.若采用水溶液代替SOCl2溶液,锂电极则与水反应生成氢氧化锂,造成电极的损耗;
A.锂电池中锂为电池的负极,失电子生成锂离子,反应式:Li -e-= Li+,A正确;
B.放电时的总反应式为电池正负极得失电子总数相等时电极反应相加,4Li+2 SOCl2=4LiCl+SO2↑+S,B正确;
C.锂电极为电池的负极,负极的电势比正极低,C正确;
D.若采用水溶液代替SOCl2溶液,锂电极则与水反应生成氢氧化锂,造成电极的损耗,D错误;
答案为D


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)鉴别KCl溶液和K2CO3的试剂是____________,离子方程式为____________________。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用______________________方法,化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:______________________,该反应中,Na2O2的作用为____________(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。 (图中铁架台等装置已略去)。

①装置A的名称是_________,A中的固体为_______________,装置B中试剂的作用为__________________________
②若Na2O2能与CO2,则装置C中的现象是_____________________________
(3)碱石灰是干燥剂,在a处收集气体,检测发现该气体中几乎都是CO2气体(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要_______________。
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)__________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中存在下列电离平衡:NH3·H2O![]()
![]() +OH-,下列情况能引起电离平衡向逆向移动的有( )
+OH-,下列情况能引起电离平衡向逆向移动的有( )
① 加NH4Cl固体 ② 加NaOH溶液 ③ 通HCl ④ 加CH3COOH溶液 ⑤ 加AlCl3固体
A. ① ② B. ① ③ ⑤ C. ③ ④ ⑤ D. ① ② ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 32gO2所含的原子数目为NA
B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA
D. 0.5NA个CO2的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
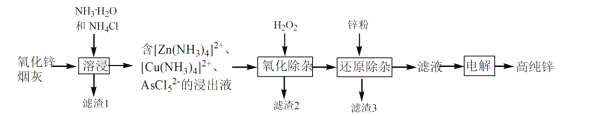
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的____ 性。
(2)滤渣1和滤渣3的主要成份分别是______、______(填化学式)。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是______;“溶浸”时温度不宜过高,其原因是______。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是______。
(5)“电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是______。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_____(写化学式)。该流程中可以循环使用的物质是_____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某学生用 0.100 mol·L-1 的 KOH 标准溶液滴定未知浓度的盐酸, 其操作可分解为如下几步:
A.移取 20.00 mL 待测盐酸溶液注入洁净的锥形瓶,并加入 2~3 滴酚酞;
B. 用 标 准 溶 液 润 洗 滴 定 管 2~3次 ;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准 KOH 溶液注入碱式滴定管至刻度“0”以上 2~3 mL; E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准 KOH 溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写)_____。
(2)上述 A 步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果_________(填“偏高”“偏低”或“不变”)。
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果_____(填“偏高”“偏低”或“不变”)。
Ⅱ.测血钙的含量时,可将 2.0 mL 血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4 晶体,反应生成 CaC2O4 沉淀。将沉淀用稀硫酸处理得 H2C2O4 后,再用酸性 KMnO4 溶液滴定,氧化产物为 CO2,还原产物为 Mn2+,若终点时用去 20.00 mL 1.0×10-4 mol·L-1 的 KMnO4 溶液。
(1)写出用 KMnO4 滴定 H2C2O4 的离子方程式_____________。
(2)判断滴定终点的方法是_________。
(3)计算:血液中含钙离子的浓度为_____g·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二环[1,1,0]丁烷(![]() )是最简单的桥环化合物。下列关于该化合物的说法错误的是
)是最简单的桥环化合物。下列关于该化合物的说法错误的是
A. 该化合物的二溴代物有4种
B. 每1mol该化合物反应生成1molC4H10需要2molH2
C. 该化合物能够发生取代反应和氧化反应
D. 该化合物中4个碳原子可能处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com