
【题目】在一定温度和压强下的气体,影响其所占体积大小的主要因素是
A.分子直径的大小B.分子间距离的大小
C.分子数目的多少D.分子间引力的大小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( ) 
A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生。
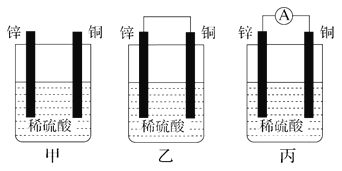
(2)用导线将电流表的两端与溶液中的锌片和铜片相连(如图丙装置所示),观察到电流表的指针发生了偏转,说明导线中有电流通过。锌片上的电极反应:______________;铜片上的电极反应:____________________________。
(3)乙、丙装置是将________能转化为________能的装置。
Ⅱ.断开1molH﹣H键,1molN﹣H键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:
(1)1molN2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ
(2)1molH2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ(不考虑可逆反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成都市近年来常常发生“毒奶粉”事件.劣质奶粉制造商为牟取暴利,大大降低了奶粉中蛋白质的含量,导致食用这种奶粉的众多婴幼儿严重营养不良乃至死亡.为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化为氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式为:2NH3+H2SO4=(NH4)2 SO4现取该奶粉样品100g,用“盖尔达法”分解其中的蛋白质,产生的氨气用7.5g溶质质量分数为19.6%的稀硫酸恰好完全吸收. 计算并回答下列问题:
(1)产生氨气的质量是多少?(计算结果精确到0.01,下同)
(2)含氮元素的质量多少?
(3)该奶粉中氮的含量是否达到了国家规定的标准.(奶粉中蛋白质的含量国家标准为:每100g婴幼儿奶粉中含12g~25g.蛋白质含氮元素的质量分数为16%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程) 
(1)反应生成的气体的体积(标况下);
(2)反应过程中转移电子的物质的量;
(3)参加反应的稀硝酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:

曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: . 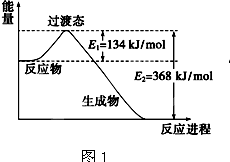
(2)观察图2a和b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系. 图a:;
图b: . 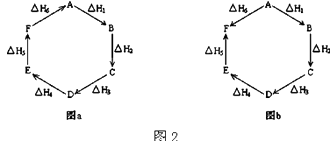
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
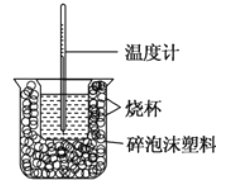
(1)图中缺少的仪器或用品有______、______。
(2)做一次完整的中和热测定实验,温度计需使用_____次。
(3)把温度为15.0℃,浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①计算表格中第一组实验测出的中和热△H1=______(保留一位小数)。
②写出表格中第二组实验的热化学方程式:_______________(保留一位小数)。
③两组实验结果差异的原因是________________。
④碱溶液过量的原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com