
【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:

曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。
【答案】 0.016 7 mol·L-1·min-1 6.75 CO2 18.8 BD CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 367 kJ·mol-1 O2+2H2O+4e-===4OH-
【解析】(1)由表中数据可知,0~1 min内,Δn(H2)=8 mol-6 mol=2 mol,则消耗氢气的浓度是2mol÷20L=0.1mol/L,所以v(H2)=0.1mol/L÷1min=0.1 mol·L-1·min-1,由速率之比等于计量系数之比可知:v(H2)∶v(CH3CH2OH)=6∶1,则v(CH3CH2OH)=0.1 mol·L-1·min-1×1/6=0.016 7 mol·L-1·min-1;由表中数据可知,H2起始投入量为8 mol,在20 L密闭容器中,CO2和H2的投料比为1∶3,则CO2起始投入量为![]() ,3 min后反应达平衡,则:
,3 min后反应达平衡,则:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
起始浓度(mol/L) 0.13 0.4 0 0
转化浓度(mol/L) 0.05 0.15 0.025 0.075
平衡浓度(mol/L) 0.08 0.25 0.025 0.075
则平衡常数K=![]() ≈6.75。
≈6.75。
(2)该反应为放热反应,升高温度平衡逆向移动,平衡时CO2与H2的含量增大,CH3CH2OH与H2O的含量降低,可知甲、乙为反应物,平衡逆向移动过程中,H2和CO2按比例(3∶1)增加,甲的含量高于乙,可知曲线乙表示的是CO2;丙、丁为生成物,反应开始时H2与CO2按3∶1的量进行投料,故生成乙醇与水的物质的量比为1∶3,即水的含量是乙醇含量的3倍,可知曲线丙、丁分别表示的是H2O、CH3CH2OH;A点为曲线乙和丙的交点,说明平衡时CO2、H2O的体积分数相同,可知两者体积也相同,设CO2、H2O的体积都是V,根据投料比有:V(H2)=3V(CO2)=3V,且V(CH3CH2OH)=1/3V(H2O)=V/3,故V总=V+V+3V+V/3=16V/3,所以A点对应的体积分数为![]() ×100%≈18.8%。(3)A、放热反应,升高温度平衡逆向移动,A错误;B、移去CH3CH2OH,生成物浓度减小,平衡正向移动,B正确;C、催化剂只能改变反应的速率,对平衡移动无影响,C错误;D、恒容容器中再充入1 mol CO2和3 mol H2,相当于增大压强,平衡正向移动,D正确。答案选BD;(4)25 ℃、1.01×105 Pa时,9.2 g液态乙醇物质的量为0.2 mol,完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,则1 mol乙醇完全燃烧恢复到原状态时,放出的热量为273.4 kJ×5=1367 kJ,故该反应的热化学方程式为CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol-1。(5)乙醇的燃料电池中,燃料乙醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子的还原反应,在碱性环境下,氧气的放电情况为O2+2H2O+4e-===4OH-。
×100%≈18.8%。(3)A、放热反应,升高温度平衡逆向移动,A错误;B、移去CH3CH2OH,生成物浓度减小,平衡正向移动,B正确;C、催化剂只能改变反应的速率,对平衡移动无影响,C错误;D、恒容容器中再充入1 mol CO2和3 mol H2,相当于增大压强,平衡正向移动,D正确。答案选BD;(4)25 ℃、1.01×105 Pa时,9.2 g液态乙醇物质的量为0.2 mol,完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,则1 mol乙醇完全燃烧恢复到原状态时,放出的热量为273.4 kJ×5=1367 kJ,故该反应的热化学方程式为CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol-1。(5)乙醇的燃料电池中,燃料乙醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子的还原反应,在碱性环境下,氧气的放电情况为O2+2H2O+4e-===4OH-。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 1 mol Cu和2 mol热浓硫酸反应,生成的SO2分子数目为NA
B. 由H2O2制得2.24 L O2,转移的电子数目为0.2NA
C. 常温常压下,8 g O2与O3的混合气体中含有4NA个电子
D. 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,并加热使之充分反应,直至Ba(OH)2溶液过量。加入Ba(OH)2溶液的体积与产生沉淀的质量和放出NH3的体积(标准状况下)的关系如下图,曲线a代表沉淀的质量变化,曲线b代表NH3的体积变化(假设NH3全部放出)。
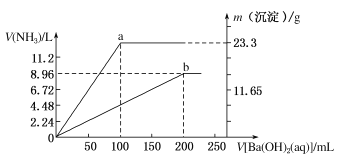
(1)混合溶液中NH![]() 的物质的量为________mol。
的物质的量为________mol。
(2)混合溶液中NO![]() 的物质的量为________mol。
的物质的量为________mol。
(3)当加入Ba(OH)2溶液的体积在100~200mL范围内,发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《本草纲目》中一条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.蒸馏B.渗析C.萃取D.干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化P的物质的量为( )
A.![]() ?mol
?mol
B.![]() mol
mol
C.![]() mol
mol
D.![]() ?mol
?mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题: 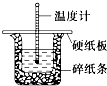
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
(4)实验中改用60mL 0.50molL﹣1盐酸跟50 mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由: .
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL 0.50molL﹣1 CH3COOH溶液(已知CH3COOH电离时吸热)进行上述实验,测得的中和热的数值会 . (均填“偏大”、“偏小”或“无影响”)
(6)平行地做一次这样的实验需要测定次温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol O的质量是 32g/mol
B.OH﹣的摩尔质量是17g
C.1mol H2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com