
【题目】下列叙述正确的是( )
A.1 mol O的质量是 32g/mol
B.OH﹣的摩尔质量是17g
C.1mol H2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:

曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是
A. K+、Fe2+、NO3-、H+ B. Na+、Ca2+、Cl-、NO3-
C. Na+、H+、Cl-、CO32- D. Na+、Cu2+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908gmol﹣1)的组成和性质,设计并完成了如下实验

取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应.
②常温下B呈液态且1个B分子含有10个电子。请回答如下问题:
(1)写出B分子的电子式 _________
(2)请写出红色固体G与足量D溶液反应的离子方程式__________
(3)X的化学式是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
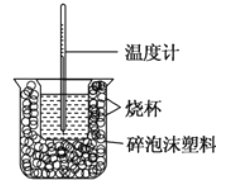
(1)图中缺少的仪器或用品有______、______。
(2)做一次完整的中和热测定实验,温度计需使用_____次。
(3)把温度为15.0℃,浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①计算表格中第一组实验测出的中和热△H1=______(保留一位小数)。
②写出表格中第二组实验的热化学方程式:_______________(保留一位小数)。
③两组实验结果差异的原因是________________。
④碱溶液过量的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4 , 与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题: 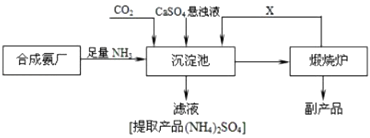
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是;
(2)工业合成氨反应的化学方程式是
(3)沉淀池中发生反应的主要方程式是
(4)上述生产流程中,有关NH3的作用及说明正确的是 A.提供制各产品所需的氮元素
B.增大CO32﹣的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是 . 从绿色化学和资源综合利用的角度说明上述流程的主要优点是 .
(6)写出硫酸钙的其它一种用途 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日照市是山东半岛蓝色经济区的重要组成部分,对海洋资源的开发受到高度重视,下列说法正确的是
A.Mg和U都属于海水中的微量元素
B.可以利用太阳能将海水蒸馏淡化生产饮用水
C.从海水中提取溴的过程不涉及氧化还原反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( ) 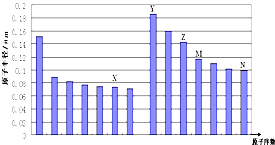
A.N、Z两种元素的离子半径相比前者较大
B.M、N两种元素的气态氢化物的稳定性相比后者较强
C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应
D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com