
【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
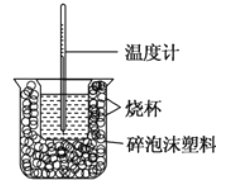
(1)图中缺少的仪器或用品有______、______。
(2)做一次完整的中和热测定实验,温度计需使用_____次。
(3)把温度为15.0℃,浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①计算表格中第一组实验测出的中和热△H1=______(保留一位小数)。
②写出表格中第二组实验的热化学方程式:_______________(保留一位小数)。
③两组实验结果差异的原因是________________。
④碱溶液过量的原因是___________。
【答案】 环形玻璃搅拌棒 烧杯上方的泡沫塑料板或硬纸板 3 -55.2KJ/mol HC1(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(1)△H=-50.2kJ/mol NH3·H2O是弱碱,在中和过程中NH3·H2O发生电离,要吸热,因而放热少 使酸完全反应
【解析】(1)根据中和热的测定装置及该图所示可判断,图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖;(2)做一次完整的中和热测定实验,温度计需测量反应前盐酸、氢氧化钠溶液的温度及二者混合反应后溶液的温度,故至少需使用3次;(3)①反应以不足量的HCl为标准计算,n(HCl)=n(H2O)=0.5mol/L×0.05L=0.025mol,Q=cm△t=4.18J/(g℃)×100g×(18.3-15)℃=1379.4J,则△H1=-1379.4J÷0.025mol=-55176J/mol≈-55.2kJ/mol;②根据以上分析可知第二组实验中Q=cm△t=4.18J/(g℃)×100g×(18-15)℃=1254J,则△H2=-1254J÷0.025mol=-50160J/mol≈-50.2kJ/mol,所以该反应的热化学方程式是HCl(aq)+NH3H2O(aq)=NH4Cl(aq)+H2O(l)△H2=-50.2kJ/mol;③反应热是酸、碱发生中和反应产生1mol水放出的热量。由于NH3H2O是弱碱,存在电离平衡,电离需要吸收热量,故反应产生1mol水放出的热量比强碱NaOH少。④根据以上分析可知碱溶液过量的原因是使酸完全反应。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
B. 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性
C. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
D. 植物秸杆的主要成分是纤维素,纤维素在催化剂作用下经水解可得葡萄糖,葡萄糖在酒化酶的作用下能转化为酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为1.12 L的容器,在同温同压下,一个盛满N2,另一个盛满CO气体,则两容器内气体的关系错误的是
A.气体分子数均为3.01×1022B.密度相等
C.原子数相等D.电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘的制取。甲、乙两种实验方案如下:
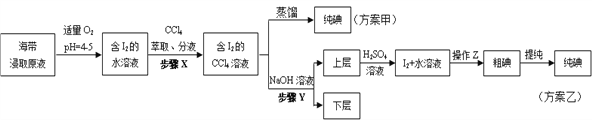
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(1)分液漏斗使用前须检漏,检漏方法为_____________
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________
(3)下列有关步骤Y的说法,正确的是_____________
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.操作Z的名称是过滤 D.NaOH溶液可以由乙醇代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol O的质量是 32g/mol
B.OH﹣的摩尔质量是17g
C.1mol H2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=__________________X=____________
(2)A在5min末的浓度是________________
(3)此时容器内的压强与开始时之比为:___________。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a. 写出它的电子式______________;
b. 指出它分子内的键型______________。
c. 指出硫元素的化合价为______________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。Se2Cl2常用作分析试剂,其结构式为_______。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
c.推测SeO2的化学性质(任写一条即可)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
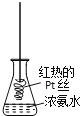
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com