
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4 , 与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题: 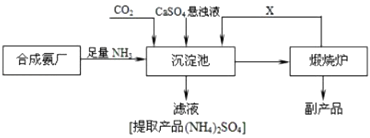
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是;
(2)工业合成氨反应的化学方程式是
(3)沉淀池中发生反应的主要方程式是
(4)上述生产流程中,有关NH3的作用及说明正确的是 A.提供制各产品所需的氮元素
B.增大CO32﹣的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是 . 从绿色化学和资源综合利用的角度说明上述流程的主要优点是 .
(6)写出硫酸钙的其它一种用途 .
【答案】
(1)蒸馏液态空气或者液化
(2)N2+3H2 ![]() 2NH3
2NH3
(3)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
(4)A、B
(5)CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成
(6)生产水泥或石膏
【解析】解:工业合成氨的反应原理为N2+3H2 ![]() 2NH3 , 将NH3和CO2通入沉淀池中并加入CaSO4 , 生成(NH4)2SO4和CaCO3 , 发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得,所以答案是:蒸馏液态空气或者液化;(2)在高温、高压、催化剂条件下氮气和氢气发生化合反应生成氨气,反应方程式为N2+3H2
2NH3 , 将NH3和CO2通入沉淀池中并加入CaSO4 , 生成(NH4)2SO4和CaCO3 , 发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得,所以答案是:蒸馏液态空气或者液化;(2)在高温、高压、催化剂条件下氮气和氢气发生化合反应生成氨气,反应方程式为N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵,反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , 所以答案是:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵,所以氨气提供制各产品所需的氮元素,故A正确; B.增大反应物浓度平衡正向移动,所以增大CO32﹣的浓度促进反应发生,故B正确;C.氨气是反应物,而不是催化剂,故C错误;故选AB;(5)在流程图中能作反应物和生成物的能循环利用,可以循环利用的物质有CO2 , 反应物能完全转化为生成物符合绿色化学理念且能充分利用资源,所以优点是生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,所以答案是:CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成;(6)硫酸钙能用于生产水泥或石膏,所以答案是:生产水泥或石膏.
2NH3;(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵,反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , 所以答案是:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵,所以氨气提供制各产品所需的氮元素,故A正确; B.增大反应物浓度平衡正向移动,所以增大CO32﹣的浓度促进反应发生,故B正确;C.氨气是反应物,而不是催化剂,故C错误;故选AB;(5)在流程图中能作反应物和生成物的能循环利用,可以循环利用的物质有CO2 , 反应物能完全转化为生成物符合绿色化学理念且能充分利用资源,所以优点是生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,所以答案是:CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成;(6)硫酸钙能用于生产水泥或石膏,所以答案是:生产水泥或石膏.


科目:高中化学 来源: 题型:
【题目】将3.2g Cu跟30.0mL 10.0molL﹣1的HNO3充分反应,还原产物有NO和NO2 , 若反应后溶液中有a mol H+ , 则此时溶液中含NO3﹣的物质的量为( )
A.0.5a mol
B.(0.1+a)mol
C.0.1a mol
D.2a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=+7kJ/mol
H2S(g)+CO(g) △H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2
H2S(g)+CO2(g) △H2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ·mol-1 | 803 | 742 | 577 | 339 | 465 |
回答下列问题:
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为____kJ。
(2)已知热化学方程式CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
(3)某温度下,在某密闭容器中进行COS的氢解反应
①当反应达到限度后,增大容器的体积,则正反应速率_____(填“增大”“减小”或“不变”);
②当容器体积不变时,若起始时充入COS和H2的体积比为1:2,下列情形能表明反应达到平衡状态的是______。
a.气体密度不变 b.COS与H2浓度比不变
c.混合气体的平均相对分子质量不变 d.COS体积分数不变
③当容器体积不变时,若COS和H2的起始物质的量比为1:a,平衡后COS和H2的物质的量比为1:10a,则此温度下H2平衡转化率为______(用含a的式子表示)。
(4)羰基硫的氢解或水解反应能否设计成原电池_____(能或否),理由是________。
(5)用金属储氢材料(MH)、铂(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理。
①原电池的负极材料是____(填化学式)。
②写出原电池的正极反应式_________,正极周围溶液pH______(填“增大”“减小”或“不变”)。
③原电池工作时,硫酸溶液的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol O的质量是 32g/mol
B.OH﹣的摩尔质量是17g
C.1mol H2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 J 是某种解热镇痛药,以 A 为原料的工业合成路线如下图所 示:

已知
分子式 B: C8H8O2 C:C8H7NO4 D:C6H5NO3 E :C6H7NO F:C9H11NO2 H:C6H 7O3
(1)写出同时符合下列条件的 F 的所有同分异构体的结构简式_____
①属 a—氨基酸:(a 碳上须含有氢原子) ② NMR 谱表明分子中含有苯环
(2)下列说法不正确的是_____
A.化合物 C 中含氧官能团有两种
B.化合物 E 既可以与 NaOH 反应又可以与 HCl 反应
C.化合物 F 能与 FeCl3 发生显色反应
D.化合物 J 的分子式为 C18H15NO5
(3)设计 G→H 的合成路线(用流程图表示,无机试剂任选)_____
(4)写出 I+F→J 的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计,请回答下列问题:
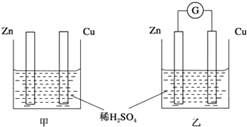
(1)以下叙述中,正确的是____。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为___________;乙为_________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:___________________________________。
Ⅱ.氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池。
(1)如果是碱性燃料电池则负极反应方程式是:____________________。
(2)如果是酸性燃料电池则正极反应方程式是:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com