
【题目】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注。据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN)。
(1)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4,该反应的氧化产物是 ,若有1 mol P4参加反应转移电子为 mol。
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka=6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1= 4.5×10-7、Ka2= 4.7×10-11,则向NaCN溶液通入少量CO2反应方程式是: 。
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是: 。
③电解法可以处理空气中的氮氧化物,用如右图示电解池,将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为 。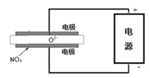
(3)①传统工业上利用氨气可以合成尿素。主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=" +72.49" kJ·mol-1
反应2NH3(g)+ CO2(g)= CO(NH2)2(s)+H2O(g)的△H= kJ·mol-1
②工业上用氨气制备硝酸,将一定质量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩余m1g铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入稀硫酸至不再产生NO为止,容器剩余铜粉m2g,则m1-m2为 。
【答案】(1)H3PO4(1分);20(1分)
(2)①CO2+NaCN+H2O=NaHCO3+HCN(2分)
②NaCN+H2O2+H2O=NaHCO3+NH3↑(2分)
③2NOx+ 4xe-= N2+ 2xO2-(2分)
(3)①—86.98 (2分) ②5.04g(2分)
【解析】
试题(1)反应过程中磷的化合价升高,所以H3PO4是氧化产物,1 mol P4参加反应化合价升高5价,所以转移5×4=20mol电子。
(2)①因为HCN的电离平衡常数在H2CO3的两极电离平衡常数之间,故向 NaCN溶液通入少量CO2反应:CO2+NaCN+H2O=NaHCO3+HCN;②能使湿润的红色石蕊试纸变蓝色的气体,是氨气,故常氰化钠能与过氧化氢溶液反应方程式:NaCN+H2O2+H2O=NaHCO3+NH3↑;③电解池阴极发生还原反应,反应方程式:2NOx+ 4xe-= N2+ 2xO2-。
(3)①据盖斯定律①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H1=" -" 159.47 kJ·mol-1,②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=" +72.49" kJ·mol-1,③2NH3(g)+ CO2(g)= CO(NH2)(s)+H2O
(g)△H3,③=①+②,△H3="-159.47+72.49=-86.98" kJ·mol-1;②档容器中剩余m1 g铁粉,生成448mlNO,物质的量=0.448/22.4=0.02mol,转移电子0.02×3=0.06mol,铁由0价变为+2价,所以生成的二价铁0.06/2=0.03mol,对应的硝酸根是0.06mol,加入硫酸时氮元素全部转化为NO,转移电子0.06×3=0.18mol,继续溶解的铁是0.18/2=0.09mol,质量=0.09×56=5.04g,所以质量变化5.04g。


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是 ( )
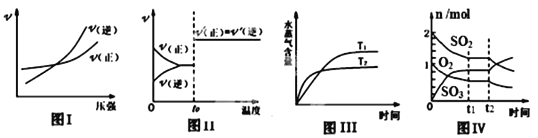
A. 图 I:反应N2+3H2![]() 2NH3在恒温情况下,反应速率与压强的关系
2NH3在恒温情况下,反应速率与压强的关系
B. 图Ⅱ:反应H2+I2![]() 2HI达平衡后,升高温度时反应速率随时间的变化
2HI达平衡后,升高温度时反应速率随时间的变化
C. 图Ⅲ:反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
D. 图Ⅳ:反应2SO2+O2![]() 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化
2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) ![]() COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=__________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =______。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。

X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体:2CO(g)+2NO(g)![]() 2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________________。
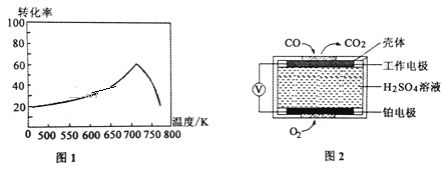
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式_______________。
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学史的,下列说法中不正确的是
A. 道尔顿——提出原子学说 B. 爱迪生——发现电子
C. 卢瑟福——提出带核的结构模型 D. 玻尔——提出了电子在核外的量子化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。
(2)若测定结果偏高,其原因可能是_____________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后又用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(3)判断滴定终点的现象是______________________。
(4)如图是某次滴定时的滴定管中的液面,其读数为________mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 18 g D2O所含有电子数为10NA
B. 1mol Na2O2发生氧化还原反应时,转移的电子数目一定为2 NA
C. 常温常压下,14g由N2与CO 组成的混合气体含有的原子数目为NA
D. 50 mL 18.4 mol·L-1的浓硫酸与足量铜在加热条件下反应,生成SO2 分子的数目为0.46 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g)ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH2=-23.5kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.3kJ/mol.
已知:H-H的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol;
(2)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g)![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.v正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,则混合液中c(CH3COO-)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计以下实验方案,从海带中提取I2。

(1)操作①的名称是______。
(2)向滤液中加入双氧水的作用是______。
(3)试剂a可以是______(填序号)。
①四氯化碳 ②苯 ③酒精 ④乙酸
(4)I–和IO3-在酸性条件下生成I2的离子方程式是________________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com