
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g)ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH2=-23.5kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.3kJ/mol.
已知:H-H的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol;
(2)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g)![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.v正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,则混合液中c(CH3COO-)=______mol/L。
【答案】1072.7 0.01molL-1min-1 10000 C 不 1+10-8-10-6
【解析】
(1)①根据反应Ⅲ及△H=反应物的键能之和-生成物的键能之和列式计算;
(2)①根据三段式利用反应2CH3OCH3(g)+4CO(g)+H2(g)CH3COOCH=CH2(g)+2CH3COOH(g)计算出平衡时各物质的浓度,结合平衡常数的表达式分析解答;②可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断; ③氩气不影响各组分的浓度,根据参与反应的物质的浓度是否变化分析判断;
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,即c(H+)=10-8mol/L,根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Li+),列式计算。
(1)根据Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-41.3kJ/mol可知,△H=反应物的键能之和-生成物的键能之和,则C≡O的键能=(-41.3kJ/mol)+(2×803kJ/mol)+(436kJ/mol)-(2×464kJ/mol)=1072.7kJ/mol,故答案为:1072.7;
(2)①设转化的氢气的物质的量为x,则
2CH3OCH3(g)+4CO(g)+H2(g)CH3COOCH=CH2(g)+2CH3COOH(g),
起始(mol) 0.2 0.4 0.1 0 0
反应(mol) 2x 4x x x 2x
平衡(mol) 0.2-2x 0.4-4x 0.1-x x 2x
则 ![]() ×100%=10%,解得x=0.05mol,0~10min内用CO浓度变化表示的平均反应速率v(CO)=
×100%=10%,解得x=0.05mol,0~10min内用CO浓度变化表示的平均反应速率v(CO)= ![]() =0.01molL-1min-1;该温度下,该反应的平衡常数K=
=0.01molL-1min-1;该温度下,该反应的平衡常数K=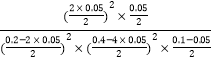 =10000,故答案为:0.01molL-1min-1;10000;
=10000,故答案为:0.01molL-1min-1;10000;
②A.v正(DME)=v逆(H2),不满足计量数关系,表明正逆反应速率不相等,该反应没有达到平衡状态,故A错误;B.该反应中气体总质量和体积始终不变,则混合气体的密度为定值,不能根据密度判断平衡状态,故B错误;C.该反应中气体总质量不变,而气体的物质的量为变量,当混合气体的平均相对分子质量不再变化时,表明该反应已经达到平衡状态,故C正确;D.c(CO)∶c(VAC)=4∶1,无法判断各组分的浓度是否继续变化,则无法判断平衡状态,故D错误;故答案为:C;
③保持温度不变,向反应釜中通入氩气增大压强,由于各组分的浓度不变,则化学平衡不移动,故答案为:不;
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,即c(H+)=10-8mol/L,根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Li+),则c(CH3COO-)+10-6mol/L=10-8mol/L+![]() mol/L,整理可得c(CH3COO-)=1mol/L+10-8mol/L-10-6mol/L=(1+10-8-10-6)mol/L,故答案为:1+10-8-10-6。
mol/L,整理可得c(CH3COO-)=1mol/L+10-8mol/L-10-6mol/L=(1+10-8-10-6)mol/L,故答案为:1+10-8-10-6。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________。
(3)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
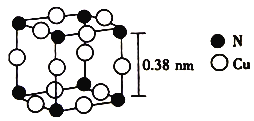
与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注。据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN)。
(1)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4,该反应的氧化产物是 ,若有1 mol P4参加反应转移电子为 mol。
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka=6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1= 4.5×10-7、Ka2= 4.7×10-11,则向NaCN溶液通入少量CO2反应方程式是: 。
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是: 。
③电解法可以处理空气中的氮氧化物,用如右图示电解池,将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为 。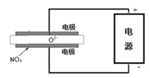
(3)①传统工业上利用氨气可以合成尿素。主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=" +72.49" kJ·mol-1
反应2NH3(g)+ CO2(g)= CO(NH2)2(s)+H2O(g)的△H= kJ·mol-1
②工业上用氨气制备硝酸,将一定质量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩余m1g铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入稀硫酸至不再产生NO为止,容器剩余铜粉m2g,则m1-m2为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. NaCl的摩尔质量是58.5g
B. 在1L水中溶解5.85gNaCl,即可配制得0.1mol/L的NaCl溶液
C. 标准状况下,22.4L H2O含有氢原子的数目为2NA
D. 17g NH3中含有分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关金属的冶炼原理下列说法正确的是( )
A. 肯定发生的是置换反应 B. 肯定发生的是分解反应
C. 肯定发生的是氧化还原反应 D. 只能用金属做还原剂冶炼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Mg、Al的混合物中加入足量盐酸,产生标准状况下的气体5.6L,再在此溶液中加入过量NaOH溶液,产生沉淀5.8克,求:
(1)Mg、Al的物质的量各为多少_________?
(2)若将此混合物投入足量的NaOH溶液中,求标准状况下产生气体的体积_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:

回答以下问题:
(1)A属于烯烃,其结构简式为____________________。
(2)B→C的反应类型是_________________,该反应生成的与C互为同分异构体的副产物是__________________(写结构简式)。
(3)E的化学名称是___________________________。
(4)写出D生成E的化学方程式_______________________________________________。
(5)H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式_________________________________________________________。
(6)写出同时满足下列条件的G的所有同分异构体__________________________________。
(写结构简式,不考虑立体异构)。
①核磁共振氢谱为3组峰; ②能使溴的四氯化碳溶液褪色;
③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,相关信息如下表。
元素 | 相关信息 |
A | 气态氢化物极易溶于水,可用作制冷剂 |
B | 单质的焰色反应为黄色 |
C | 单质是黄绿色气体,可用于自来水消毒 |
D | –2价阴离子的电子层结构与Ar原子相同 |
请根据表中信息回答:
(1)A在周期表中位于第______周期______族。
(2)用电子式表示B与C形成化合物的过程:______。
(3)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)______。
(4)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______。
a.其单质在常温下呈固态
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3
d.非金属性比C元素的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com