
【题目】二元化合物X呈黑棕色晶体,易潮解,易溶于水、乙醇和乙醚;熔点306℃,沸点315℃,400℃时存在二聚体。将X加热到200℃以上释放出一种单质气体:取1.2000 g X,加热完全分解为晶体B和气体C;气体C用足量KI溶液吸收,再用0.2500 mol/L Na2S2O3溶液进行滴定,消耗29.59 mL;晶体B可溶于水,所得溶液用0.0500 mol/L的K2Cr2O7溶液进行滴定,消耗24.66 mL。设分解反应转移电子数为n,则X的摩尔质量为___________;满足条件的X是___________。
【答案】162.5 g/mol FeCl3
【解析】
由X的物理性质知X易升华,是分子晶体。加热分解时发生氧化还原反应,气体C用足量KI溶液吸收,再用0.2500 mol/L Na2S2O3溶液进行滴定,晶体B的溶液用0.0500 mol/L的K2Cr2O7溶液进行滴定,两个过程电子转移量相等。X的质量是两元素质量之和,两种元素物质的量之比等于化学式中原子个数之比。
气体C用足量KI溶液吸收,再用0.2500 mol/L Na2S2O3溶液进行滴定,反应时C中元素化合价降低,KI被氧化为I2,I2再被Na2S2O3还原为I-,符合此条件的单质为氯气,所以X中含氯元素;X分解得到B,所得溶液用0.0500 mol/L的K2Cr2O7溶液滴定,Cr元素被还原,B中元素被氧化,溶液中有变价的金属元素是铁元素,所以X中含铁元素,X中含铁、氯两种元素。由电子守恒得关系式:6Fe2+~ K2Cr2O7, n(Fe2+)=6n(K2Cr2O7)=6![]() 24.66 mL
24.66 mL![]() —3L/ml,m(Fe2+)= n(Fe2+)
—3L/ml,m(Fe2+)= n(Fe2+)![]() ,
,
n(Cl-)=m (Cl-)/M (Cl-)=[1.2- m(Fe)]/ M (Cl-),n(Fe): n(Cl)=1:3,所以X化学式为FeCl3,,所以摩尔质量为162.5 g/mol,
故答案为162.5 g/mol ;FeCl3。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
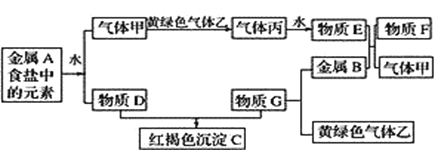
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0molL﹣1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
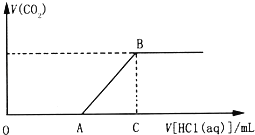
(1)若OA=AC时,通入CO2后,所得溶液的溶质成分是 ________________.
(2)若OA>AC时,OA段发生反应的离子方程式是________________________________
(3)若A点数值为80,C点数值为260,试确定通入CO2后得到的溶液溶质成 分及其物质的量浓度.(有几种填几种,不必填满,成分用化学式表示)
①成分1:________________物质的量浓度:________
②成分2:_______________ 物质的量浓度:_________
③成分3:_______________ 物质的量浓度:_________
④成分4:______________ _物质的量浓度:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
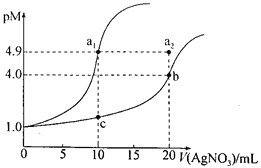
A. 该温度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三点所示溶液中c(Ag+):al>b>c
C. 若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D. 用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于各图的说法(其中①③④中均为情性电极)正确的是( )
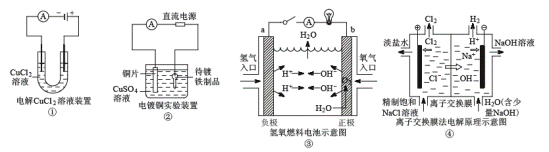
A.①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析以下氧化还原反应:
(1)H2+CuO ![]() Cu +H2O中的氧化剂:_______,还原产物:_______,H2 →H2O发生的是_____反应,用双线桥表示该反应电子转移的方向和数目_________________;
Cu +H2O中的氧化剂:_______,还原产物:_______,H2 →H2O发生的是_____反应,用双线桥表示该反应电子转移的方向和数目_________________;
(2)MnO2+ 4HCl ![]() MnCl2 + Cl2↑+ 2H2O中氧化剂:________,还原剂:________,MnO2 →MnCl2是被_____(氧化或还原),氧化产物是_________。
MnCl2 + Cl2↑+ 2H2O中氧化剂:________,还原剂:________,MnO2 →MnCl2是被_____(氧化或还原),氧化产物是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的装置中正确的是_______(填字母)。
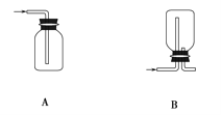
漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同,漂白粉与稀盐酸发生复分解反应以增强漂白性,化学方程式为_________。漂白粉与浓盐酸发生氧化还原反应会生成氯气,化学方程式为____________。
(2)图1是某同学制备氯水的装置图。
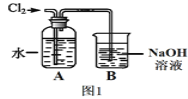
①装置B中发生反应的化学方程式为__________________。
②检验一瓶氯水是否已经完全变质,可选用的试剂是______________(填序号)。
A.硝酸银溶液B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
③氯水久置变质的主要反应方程式表示为______________________。
(3)已知氧化性:Br2>Fe3+。若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______(填离子符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com