
【题目】乙苯是重要的化工原料,有关乙苯的转化关系如图所示。已知
CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
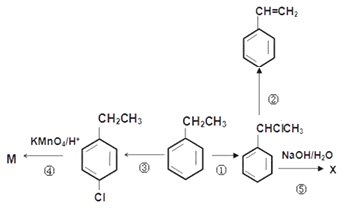
请回答下列问题:
(1)写出下列反应进行时的试剂与条件:反应②______________,反应③______________;
(2)写出下列反应的类型:反应①______________,④反应______________;
(3)写出下列物质的结构简式:M____________________
(4)②反应后的有机产物最多有多少碳原子共面______________
(5)写出下列反应的化学方程式:反应⑤________________________________________________;
【答案】氢氧化钠醇(乙醇)溶液、加热 Cl2、(Fe)FeCl3催化剂 取代反应 氧化反应 ![]() 8
8 ![]() +NaOH
+NaOH![]()
![]() +NaCl
+NaCl
【解析】
反应①为 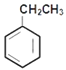 +Cl2
+Cl2 ![]()
![]() +HCl;反应②为
+HCl;反应②为![]() →
→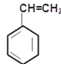 ,结合题中已知可知,发生类似CH3CH2Br+NaOH
,结合题中已知可知,发生类似CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O的反应;反应③为
CH2=CH2+NaBr+H2O的反应;反应③为 +Cl2
+Cl2 ![]()
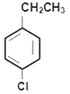 +HCl;反应④为
+HCl;反应④为 被酸性高锰酸钾氧化成
被酸性高锰酸钾氧化成![]() ,为氧化反应;反应⑤发生类似CH3CH2Br+NaOH
,为氧化反应;反应⑤发生类似CH3CH2Br+NaOH![]() CH3CH2OH+NaBr的反应,故X的结构简式为
CH3CH2OH+NaBr的反应,故X的结构简式为![]() 。
。
(1)反应②为![]() →
→ ,反应的条件为氢氧化钠醇(乙醇)溶液、加热;反应③为
,反应的条件为氢氧化钠醇(乙醇)溶液、加热;反应③为 +Cl2
+Cl2 ![]()
 +HCl,反应的条件为Cl2、(Fe)FeCl3催化剂;
+HCl,反应的条件为Cl2、(Fe)FeCl3催化剂;
(2)反应①为取代反应,反应④为氧化反应;
(3)根据分析,M的结构式为![]() ;
;
(4)由苯分子、乙烯分子等结构共面可知 中所有的碳原子都可以共面,所以最多有8个碳原子共面;
中所有的碳原子都可以共面,所以最多有8个碳原子共面;
(5)反应⑤的化学方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl。
+NaCl。


科目:高中化学 来源: 题型:
【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:

①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。

用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”。已知它易溶于水,难溶于乙醇,在中性或碱性环境中稳定,受热、遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
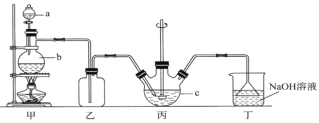
(1)装置甲中,a仪器的名称是____________;a中盛有浓硫酸,b中盛有亚硫酸钠,实验中要控制SO2生成速率,可以采取的措施有_________________________(写出一条即可)。
(2)装置乙的作用是____________________________________。
(3)装置丙中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为:________________________________________。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为_________。(实验中供选用的试剂及仪器:CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管.提示:室温时CaCO3饱和溶液的pH=9.5)
(5)反应结束后过滤丙中的混合物,滤液经蒸发、结晶、过滤、洗涤、干燥等得到产品,生成的硫代硫酸钠粗品可用_____________洗涤。为了测定粗产品中Na2S2O3·5H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应)。称取1.50g粗产品溶于水,用0.20 mol·L-1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中![]() 全部被氧化为
全部被氧化为![]() 时,消耗高锰酸钾溶液体积40.00mL。
时,消耗高锰酸钾溶液体积40.00mL。
①写出反应的离子方程式:________________________________________。
②产品中Na2S2O3·5H2O的质量分数为____________________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
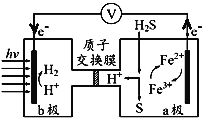
A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CH-CH3 C.C7H16 D.CH2=CH—CH=CH2 E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)1molE完全燃烧消耗氧气的物质的量____________________。
(3)C与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B在催化剂条件下发生加聚反应的化学方程式为_________________________。
(5)C的同分异构体中含有三个支链的结构简式______________,其系统命名为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是

A. 用装置甲制取一氯甲烷
B. 用装置乙在实验室制取氨气
C. 用装置丙萃取溴水中的溴
D. 用装置丁在实验室制蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”(主要成分为NaClO)能有效杀灭新型冠状病毒,某化学小组对“84消毒液”的制备和性质进行研究。请回答下列问题:
I.甲同学查阅资料知道可以利用氯气与氢氧化钠溶液反应制取“84消毒液”,同时发现“在加热情况下卤素与碱液发生如下反应:3X2+6OH-→5X-+XO3-+3H2O”。由此设计了如下装置。
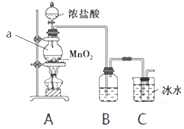
(1)仪器a的名称为__________,B中所用试剂为__________。
(2)A中发生反应的离子方程式为________。
(3)有同学认为该实验存在明显的缺陷,如何改进:________。
II.乙同学阅读某“84消毒液”的包装说明得到以下信息:
严禁与洁厕灵(主要成分盐酸)同时使用。
有效氯含量在5%以上。
有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征。
(1)“84消毒液”与洁厕灵同时使用会产生有毒的氯气,写出反应的离子方程式___。
(2)乙同学进行如下实验测定有效氯:
步骤一:取C中大试管溶液5 g于锥形瓶,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液。
步骤二:用0.1000 mol·L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
步骤一反应的离子方程式为________。通常选用__________作指示剂,滴定至终点的现象________。此消毒液有效氯含量为__________%(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
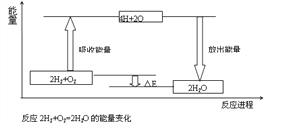
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com