
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯(难溶于水,密度比水大的油状液体)的反应原理,下列关于硝基苯的制备和纯化的装置不正确的是
![]()
A. 浓硫酸与浓硝酸混合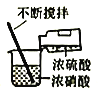
B. 制备硝基苯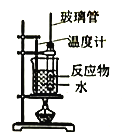
C. 用氢氧化钠溶液分离硝基苯中混有的酸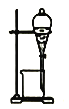
D. 分离硝基苯中混有的苯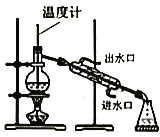
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是重要的化工原料,有关乙苯的转化关系如图所示。已知
CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
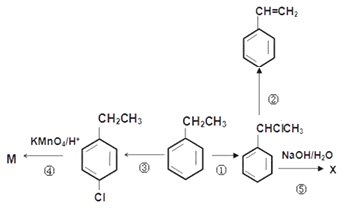
请回答下列问题:
(1)写出下列反应进行时的试剂与条件:反应②______________,反应③______________;
(2)写出下列反应的类型:反应①______________,④反应______________;
(3)写出下列物质的结构简式:M____________________
(4)②反应后的有机产物最多有多少碳原子共面______________
(5)写出下列反应的化学方程式:反应⑤________________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
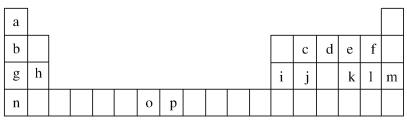
(1)元素p为26号元素,请写出其基态原子的电子排布式________________。
(2)d与a反应的产物的分子,空间构型为_________________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/ (kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________。
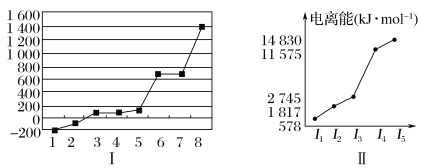
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是________(填图中的序号)。
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下刎有关实验装置、操作,不能实现相应实验目的的是

A. 装置甲可用酸性KMnO4溶液滴定FeSO4溶液
B. 用装置乙进行实验时若逐滴滴加AgNO3溶液先出现黄色沉淀,可说明 Ksp(AgCl)>Ksp(AgI)
C. 装置丙可用于收集氢气
D. 装置丁可用于 NaOH溶液除去溴苯中单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:
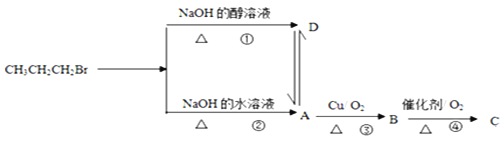
(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
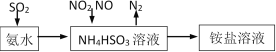
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。

(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com