
【题目】美国科学家罗伯特莱夫科维茨和布莱恩克比尔卡因“G 蛋白偶联受体研究”而获得2012年诺贝尔化学奖,他们将碘的同位素附着到各种激素上,借助放射学找到一些受体,进一步研究出“G 蛋白偶联受体”发挥的作用和机理,下列有关说法正确的是( )
A.放射性同位素![]() I 原子核内中子数与质子数的差为 78
I 原子核内中子数与质子数的差为 78
B.蛋白质是生物体维持生命活动所需能量的主要来源
C.动物蛋白质和植物蛋白质混合摄入,更能增强蛋白质的营养作用
D.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol/L的NaAlO2溶液中加入一定量的稀HNO3,将所得溶液加热、蒸干并灼烧直至质量不再变化,此时固体的质量为
A.1.09gB.1.20 gC.1.36gD.1.63g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
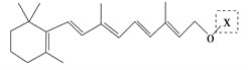
为了研究X的结构,将化合物A在一定条件下水解只得到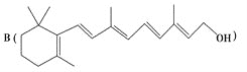 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t变化的曲线如图所示。下列说法正确的是( )
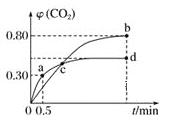
A.b点时,CO的转化率为20%
B.容器内的压强保持恒定,表明反应达到平衡状态
C.b点和d点的化学平衡常数:Kb>Kd
D.0→a点时,0到0.5 min反应速率v(CO)=0.3 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成Hb·CO,使血红蛋白失去输送 O2功能。CO进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:______。
(2)抽烟时,进入肺部的空气中c(CO)=10-6mol·L-1,c(O2)=10-2mol·L-1,则c(Hb·CO)为c(Hb·O2)的___________倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与c(CO)的比值应大于_____。
Ⅱ.在某一温度条件下, Bodensteins 研究了反应:2HI(g)![]() H2(g) +I2(g),气体混合物中 HI 的物质的量浓度x(HI)(mol·L-1)与反应时间t的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度x(HI)(mol·L-1)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20 min,v正=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池如口图所示,下列判断中正确的是( ).

A.该原电池的工作原理是Cu+2Ag+=2Ag+Cu2+
B.实验过程中取出盐桥,原电池能继续工作
C.实验过程中,左侧烧杯中NO3-浓度不变
D.实验过程中电子流向为:Cu极→Cu(NO3) 2溶液→AgNO3溶液→Ag极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com