
【题目】将小块生铁分别置于少量的饱和食盐水或稀醋酸溶液中,一定时间后可观察到的现象是
A.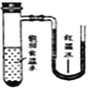 B.
B.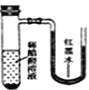 C.
C.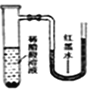 D.
D.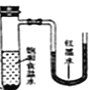
【答案】A
【解析】
A. 生铁中的Fe、C及食盐溶液构成原电池,由于电解质溶液为中性环境,发生吸氧腐蚀,溶解在食盐溶液中的O2得到电子,发生还原反应,由于O2不断消耗,使试管中气体压强减小,在外界大气压强作用下,红墨水会不断向左移动,看到U形管内红墨水左升右降,A正确;
B. 生铁中的Fe、C及醋酸溶液构成原电池,发生析氢腐蚀,反应产生氢气,使试管中气体增大,红墨水会不断向右移动,看到U形管内红墨水左降右升,B错误;
C. 由于是敞口容器,反应产生H2不断逸出,U形管内红墨水左右两侧高度都不变,C错误;
D. 发生的是吸氧腐蚀,小试管中气体压强减小,红墨水会不断向左移动,看到U形管内红墨水应该是左升右降,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】美国科学家罗伯特莱夫科维茨和布莱恩克比尔卡因“G 蛋白偶联受体研究”而获得2012年诺贝尔化学奖,他们将碘的同位素附着到各种激素上,借助放射学找到一些受体,进一步研究出“G 蛋白偶联受体”发挥的作用和机理,下列有关说法正确的是( )
A.放射性同位素![]() I 原子核内中子数与质子数的差为 78
I 原子核内中子数与质子数的差为 78
B.蛋白质是生物体维持生命活动所需能量的主要来源
C.动物蛋白质和植物蛋白质混合摄入,更能增强蛋白质的营养作用
D.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成:
(1)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,溶液中的c(OH-)约为_______mol·L-1;0.1 mol ·L-1的(NH4)2SO3溶液显________(填“酸”“碱性”或“中性”)。
(2)某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙中电解质溶液含溶质均为1 mol。将电源接通后,向乙中滴入酚猷溶液,在F极附近显红色。试回答下列问题:

①电源A极的名称是__________。
②乙装置中电解反应的总化学方程式:___________。
③当电路中通过4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入_______(填某一种物质的化学式和物质的量)。
④装置丁中的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.恒容密闭容器中进行的反应3A(g)![]() B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大
B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大
B.对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
C.将AlCl3溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为Al2O3
D.反应NH3(g)+HCl(g)=NH4Cl(s)△H<0在任何条件下均能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。恒容条件下,下列能使
CH3OH(g)。恒容条件下,下列能使![]() 增大的有
增大的有
A.升高温度B.充入CO气体
C.再充入1 mol CO和2 mol H2D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
(1)该反应中被氧化是元素是_________;写出该反应的平衡常数表达式:K=_________。增大NO2浓度,平衡常数K_________。(填“增大”、“减小”或“不变”)
(2)若上述反应在密闭容器中进行,能表明反应达到平衡状态的是_________(选填编号)。
a. 混合气体颜色保持不变 b. NO2和NO的体积比保持不变
c. 每消耗1 mol SO2的同时生成1 mol SO3 d. 体系中气体平均摩尔质量保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO2)=_________(用相关字母表示)。
(4)请写出两种能提高平衡转化率的措施____________、______________。
(5)其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选择Fe2O3作催化剂的主要原因是___________
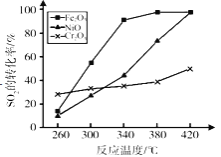
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生反应并达到平衡:3X(g)+Y(g)![]() 2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的
2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的![]() ,则下列叙述正确的是
,则下列叙述正确的是
A.升高温度,平衡向正反应方向移动
B.起始时刻n(X) : n(Y)= 2 : 1
C.充入氦气增大容器内的压强,Y的转化率提高
D.若以X表示的反应速率为0.2mol/(L·s),则以Z表示的反应速率为0.3mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g)。CO2 (g)的平衡物质的量浓度c (CO2)与温度T 的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2 (g)的平衡物质的量浓度c (CO2)与温度T 的关系如图所示。下列说法错误的是
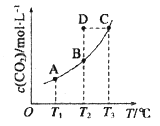
A.反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)为吸热反应
CO2(g)+H2(g)为吸热反应
B.在T2时,若反应处于状态D,则一定有υ正>υ逆
C.平衡状态A 与C 相-比,平衡状态A 的c(CO)大
D.若T1、T2 时的平衡常数分别为K1、K2则K1> K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A. B.
B.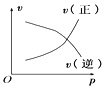 C.
C.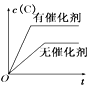 D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com