
����Ŀ�����÷�ӦNO2(g)+SO2(g)![]() SO3(g)+NO(g) ��H=-Q kJ/mol(Q>0)�ɴ���NO2��SO2�ȴ�����Ⱦ�����ʮ����Ҫ�����塣���������գ�
SO3(g)+NO(g) ��H=-Q kJ/mol(Q>0)�ɴ���NO2��SO2�ȴ�����Ⱦ�����ʮ����Ҫ�����塣���������գ�
(1)�÷�Ӧ�б�������Ԫ����_________��д���÷�Ӧ��ƽ�ⳣ������ʽ��K=_________������NO2Ũ�ȣ�ƽ�ⳣ��K_________��(����������������С������������)
(2)��������Ӧ���ܱ������н��У��ܱ�����Ӧ�ﵽƽ��״̬����_________(ѡ����)��
a. ���������ɫ���ֲ��� b. NO2��NO������ȱ��ֲ���
c. ÿ����1 mol SO2��ͬʱ����1 mol SO3 d. ��ϵ������ƽ��Ħ���������ֲ���
(3)һ���¶��£����ݻ�ΪV L�������з���������Ӧ��t min�ڣ�SO2�����ʵ����½���a mol�������ʱ����v(NO2)=_________(�������ĸ��ʾ)��
(4)��д�����������ƽ��ת���ʵĴ�ʩ____________��______________��
(5)����������ͬ��������ͬʱ��������Ӧ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼ�������Ǵ����۸����أ�������ѡ��Fe2O3����������Ҫԭ����___________
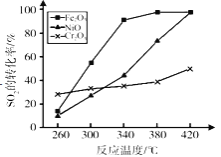
���𰸡�S ![]() ���� ab
���� ab ![]() mol/(L��min) ����NO2 �Ƴ�SO3 300-420��䣬��Ч�ʽϸ�
mol/(L��min) ����NO2 �Ƴ�SO3 300-420��䣬��Ч�ʽϸ�
��������
(1)����������ԭ��Ӧ������Ԫ�ػ��ϼ����߱����������ϼ۽��ͱ���ԭ�����жϣ����û�ѧ��Ӧ��ƽ�ⳣ���ĺ�����д��
(2)ƽ���־����|�淴Ӧ������ͬ�����ɷ�Ũ�ȱ��ֲ��������
(3)ͬһ��Ӧ����ͬ��Ӧ��������������֮�ȵ��ڻ�ѧ������֮�ȣ���v=![]() ��
��
(4)�ɽ��Ӱ��ƽ������ط�����ͨ���ı�Ӱ��ƽ����������ٽ�ƽ�������ƶ������SO2��ת���ʣ�
(5)���ݴ����Ĵ�Ч�ʼ������ﵽ��Ѵ�Ч��ʱ���¶ȷ�����
(1)�ڸ÷�Ӧ�У�SԪ�ػ��ϼ��ɷ�ӦǰSO2�е�+4�۱�Ϊ��Ӧ��SO3�е�+6�ۣ� SԪ�ػ��ϼ����ߣ�ʧȥ���ӱ��������˷�Ӧ��ƽ�ⳣ������ʽ��K=![]() ����ѧƽ�ⳣ��ֻ���¶��йأ�����NO2��Ũ�ȣ��Ի�ѧƽ�ⳣ����Ӱ�죬����Kֵ���䣻
����ѧƽ�ⳣ��ֻ���¶��йأ�����NO2��Ũ�ȣ��Ի�ѧƽ�ⳣ����Ӱ�죬����Kֵ���䣻
(2)a��ƽ����ϵ��ֻ��NO2�����Ǻ���ɫ���壬���������ɫ���ֲ��䣬˵��NO2Ũ�Ȳ��䣬��Ӧ�ﵽƽ��״̬��a��ȷ��
b���ڷ�Ӧ������NO2��NO�����֮��Ϊ��������NO2��NO�����֮�ȱ��ֲ��䣬��˵����Ӧ�ﵽƽ��״̬��b��ȷ��
c��ÿ����1 mol SO2��ͬʱ����1 molSO3��˵����Ӧ������У�����֤����Ӧ�ﵽƽ��״̬��c����
d����Ӧǰ��������������䣬��������Ҳ���䣬��Ӧ��������ϵ�������ܶ�ʼ�ղ��䣬������ϵ�����ܶȲ��䲻��֤����Ӧ�ﵽƽ��״̬��d����
�ʺ���ѡ����ab��
(3)һ���¶��£����ݻ�ΪV L�������з���������Ӧ��t min�ڣ�SO2�����ʵ����½���a mol�������ʱ����v(SO2)=![]() =
=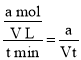 mol/(L��min)����������ͬʱ�䱻��Ӧ���ʱȵ������ʵĻ�ѧ�������ıȣ���֪���ʱ����v(NO2)=v(SO2)=
mol/(L��min)����������ͬʱ�䱻��Ӧ���ʱȵ������ʵĻ�ѧ�������ıȣ���֪���ʱ����v(NO2)=v(SO2)=![]() mol/(L��min)��
mol/(L��min)��
(4)�˷�Ӧ������ӦΪ���ȷ�Ӧ������ƽ���ƶ�ԭ����ͨ��NO2������NO��SO3�������¶Ȼ�ͨ��O2�Ⱦ��ܴٽ�ƽ�������ƶ����ﵽ���SO2��ת����Ŀ�ģ�
(5)��ͼʾ��֪��Fe2O3��300-420��䣬��Ч�ʽϸߡ�


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����. ��֪��CO �Ķ��Ա����� CO ��Ѫ�쵰�ף�Hb����ϳ�Hb��CO��ʹѪ�쵰��ʧȥ���� O2���ܡ�CO����ѪҺ��������ƽ�⣺CO��Hb��O2![]() O2��Hb��CO����֪���������� 37���£���ƽ�ⳣ��Ϊ 220���Իش�
O2��Hb��CO����֪���������� 37���£���ƽ�ⳣ��Ϊ 220���Իش�
��1��ú���ж����ˣ�����ͨ�������ѹ���յķ��������Σ����û�ѧƽ���ԭ������˵����______��
��2������ʱ������β��Ŀ�����c��CO����10-6mol��L-1��c��O2����10��2mol��L-1����c��Hb��CO��Ϊc��Hb��O2����___________����
��3����֪��ѪҺ��c��Hb��CO��/c��Hb��O2���ı�ֵ���� 0.02ʱ���˵�������ܿ��ܵ����ˣ�Ϊ�����˵������ܵ����ˣ�c��O2����c��CO���ı�ֵӦ����_____��
��.��ijһ�¶������£� Bodensteins �о��˷�Ӧ��2HI��g��![]() H2��g�� ��I2��g�������������� HI �����ʵ���Ũ��x��HI����mol��L-1���뷴Ӧʱ��t�Ĺ�ϵ���±���
H2��g�� ��I2��g�������������� HI �����ʵ���Ũ��x��HI����mol��L-1���뷴Ӧʱ��t�Ĺ�ϵ���±���
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
��һ������ | x��HI�� | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
�ڶ������� | x��HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
��4����������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ_________��
��5��������Ӧ������Ӧ����Ϊv��=k��x2��HI�����淴Ӧ����Ϊv��=k��x��H2����x��I2��������k����k��Ϊ���ʳ�������k��Ϊ_________����K��k����ʾ������k��=0.002��min��1����һ��ʵ��ʱ����t=20 min��v��=___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. �л���A���������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������AΪ��ɫҺ�壬������ˮ��Ϊ�о�A �������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
�ٳ�ȡ9.0gA������ʹ�������������ܶ�����ͬ������H2��45 �� | ��ͨ��������գ���1��A����Է�������Ϊ________ |
�ڽ���9.0gA��������O2�г�� ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g | ��2��A�ķ���ʽΪ________ |
����֪A���й�������COOH����OH����A�ĺ˴Ź���������ͼ�� |
|
��3������������A�Ľṹ��ʽΪ________ | |
II. ��ҵ�ϳ���A����Ϊԭ�Ϻϳ�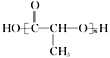 ���÷�Ӧ��������______������ĸ���ţ���ͬ����Ӧ��
���÷�Ӧ��������______������ĸ���ţ���ͬ����Ӧ��
A �Ӿ� B ����
III. ���й������ʵķ��롢�ᴿʵ���е�һЩ��������������ȷ����_______��
A ����װ����װ��ʱ���¶ȼƵ�ˮ����Ӧ����Һ����
B ��96%�Ĺ�ҵ�ƾ���ȡ��ˮ�Ҵ�ʱ���ȼ�����ˮCuSO4���ٹ���
C �ڱ������ؽᾧʵ���У��ֱ���������ܽ��Ҫ������������ˮ
D �ڱ������ؽᾧʵ���У����ֱ�������ȫ�ܽ��Ҫ��ȴ�������ٹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����300Kʱ��A(g)+B(g)![]() 2C(g)+D(s)�Ļ�ѧƽ�ⳣ��K=4���ڸ��¶��£���1 L�����м���1 mol A��1 molB������Ӧ����������������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־���ǣ� ��
2C(g)+D(s)�Ļ�ѧƽ�ⳣ��K=4���ڸ��¶��£���1 L�����м���1 mol A��1 molB������Ӧ����������������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־���ǣ� ��
��C������������C�������������
�ڵ�λʱ��������a mol A��ͬʱ����2a mol C
��A��B��C��Ũ�Ȳ��ٱ仯
��C�����ʵ������ٱ仯
�ݻ���������ѹǿ���ٱ仯
���������ܶȲ��ٱ仯
A.�ڢ�B.�ڢ�C.�ڢ�D.�ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����С�������ֱ����������ı���ʳ��ˮ��ϡ������Һ�У�һ��ʱ���ɹ۲쵽��������
A. B.
B.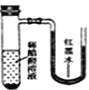 C.
C.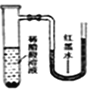 D.
D.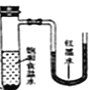
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������õķ���ʴ�ԣ��ڹ�����ҵ���зdz���Ҫ�����á����������գ�
��1����ԭ�Ӻ����������___�ֲ�ͬ����չ������___�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2���أ�Ga������ͬ�塣д���ص��Ȼ���Ͱ�ˮ��Ӧ�Ļ�ѧ����ʽ___��
��3��������ͬ���ڡ�SiO2�ǹ����β�����Na2CaSi6O14������Ҫ�ɷ֣�Na2CaSi6O14Ҳ��д����������ʽ___��ʢ��NaOH��Һ���Լ�ƿ���ò���ƿ�������γ�ճ�ԵĹ����ζ�����������Ӧ�Ļ�ѧ����ʽΪ___����ʯ���������ᣬ��ͬ�ʯ����ԭ�ӵ����ʵ���������ͬ�����Ƴ�ʯ��ѧʽNaAlSi3O8����֪�Ƴ�ʯ�Ļ�ѧʽΪ___��
��4�������ͽ��������ﷴӦ�Ʊ����������ǹ�ҵ�ϳ��õķ������磺2Al��4BaO![]() 3Ba����BaOAl2O3��������Al�Ľ����Ա�Ba�Ľ�����___��ѡ����ǿ����������������������������ȡBa����Ҫԭ����___��
3Ba����BaOAl2O3��������Al�Ľ����Ա�Ba�Ľ�����___��ѡ����ǿ����������������������������ȡBa����Ҫԭ����___��
a������ʱAl�Ļ����Դ���Ba b������������BaO�ֽ�
c������ʱBaOAl2O3��Al2O3�ȶ� d��Ba�ķе��Al�ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�����������ʵ�pH��Ũ�����±���ʾ���ش��������⣺
��� | �� | �� | �� | �� |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
pH | 11 | 11 | 3 | 3 |
Ũ�� | c1 | c2 | c3 | c4 |
(1)c1____������>����<������=����c2��
(2)��Һ��ˮ�ĵ���̶���____������>����<������=��������
(3)�ֱ��ˮϡ��10����ϡ�ͺ�������Һ��pH�ɴ�С��˳��Ϊ____������ţ���
(4)����Һ������Һ�������ϣ���Һ��pH____7������>����<������=������������Һ�ζ�����Һ���ζ������в����ܳ��ֵĽ����____��
A. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(5)������ͭ����Һ��������ƽ�⣺Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq)�������£�Ksp=c(Cu2+)��c2(OH-)=2��10-20��ij����ͭ��Һ��c(Cu2+)=0.02 mol/L����Ҫ����Cu(OH)2������Ӧ������Һʹ֮pH>_____��
Cu2+(aq)+2OH-(aq)�������£�Ksp=c(Cu2+)��c2(OH-)=2��10-20��ij����ͭ��Һ��c(Cu2+)=0.02 mol/L����Ҫ����Cu(OH)2������Ӧ������Һʹ֮pH>_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��㷺����ȼ�ϵ�ص�ȼ�ϣ�������Ȼ�����ϳɣ���֪��
��2CH4(g)��O2(g)===2CO(g)��4H2(g) ��H����71 kJ/mol
��CO(g)��2H2(g)===CH3OH(l) ��H����90.5 kJ/mol
��CH4(g)��2O2(g)===CO2(g)��2H2O(l) ��H����890 kJ/mol
�������ܵó��Ľ�����(�� ��)
A.��Ӧ�ڲ���Ҫ���Ⱦ��ܽ���
B.CO(g)��2H2(g)===CH3OH(g) ��H����90.5 kJ/mol
C.�״���ȼ������H����764 kJ/mol
D.��CO��ȼ������H����283.0 kJ/mol����H2��ȼ������H����285.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10L���ܱ������У�1molA��1molB���з�Ӧ��2A(g)+B(g)![]() 2C(g)���ﵽƽ��ʱ����0.6molC������˵����ȷ���ǣ� ��
2C(g)���ﵽƽ��ʱ����0.6molC������˵����ȷ���ǣ� ��
A.���������ܶȱ��ֲ���ʱ�������жϷ�Ӧ�Ѵﵽƽ��
B.�����������䣬�����������Ϊ5L��C��ƽ��Ũ�ȱ�Ϊԭ����2��
C.�ﵽƽ��ʱ��C������ٷֺ���Ϊ0.353
D.�����������䣬������ѹǿ��������A��ת���ʼ�С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com