
【题目】甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)===2CO(g)+4H2(g) ΔH=-71 kJ/mol
②CO(g)+2H2(g)===CH3OH(l) ΔH=-90.5 kJ/mol
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
下列不能得出的结论是( )
A.反应②不需要加热就能进行
B.CO(g)+2H2(g)===CH3OH(g) ΔH>-90.5 kJ/mol
C.甲醇的燃烧热ΔH=-764 kJ/mol
D.若CO的燃烧热ΔH=-283.0 kJ/mol,则H2的燃烧热ΔH=-285.8 kJ/mol
【答案】A
【解析】
A.反应②的△H<0,△S<0,反应是否自发进行与温度有关,在低温下,△H-T△S<0,反应可以自发进行,有些自发反应也需要一定条件才能发生,A错误;
B.1mol CH3OH(g)的能量高于1molCH3OH(l),反应物的总能量相同,根据能量守恒定律,CO(g)+2H2(g)===CH3OH(g) ΔH>-90.5 kJ/mol,B正确;
C.据盖斯定律③×2-①-②×2得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)ΔH=-1528kJ/mol,所以,甲醇的燃烧热ΔH=-764 kJ/mol,故C正确;
D.CO的燃烧热ΔH=-283.0 kJ/mol,热化学方程式如下:
①2CH4(g)+O2(g)===2CO(g)+4H2(g) ΔH=-71 kJ/mol
②CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
依据盖斯定律![]() ,可得H2 (g)+
,可得H2 (g)+![]() O2(g)=== H2O (g) ΔH=-285.8 kJ/mol,H2的燃烧热ΔH=-285.8 kJ/mol,D正确;
O2(g)=== H2O (g) ΔH=-285.8 kJ/mol,H2的燃烧热ΔH=-285.8 kJ/mol,D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】取m g AgNO3固体粉末充分加热,得到a L气体和b g 固体。将气体用足量的水吸收,剩余气体的体积为c L(气体体积均为同温同压下测定)。下列结论一定正确的是
A.aL气体的平均相对分子质量为30.67
B.aL气体被水吸收时转移电子的物质的量为(![]() )mol
)mol
C.cL剩余气体是O2,且c= ![]()
D.将m g AgNO3溶于水,再加足量的盐酸,可生成沉淀![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
(1)该反应中被氧化是元素是_________;写出该反应的平衡常数表达式:K=_________。增大NO2浓度,平衡常数K_________。(填“增大”、“减小”或“不变”)
(2)若上述反应在密闭容器中进行,能表明反应达到平衡状态的是_________(选填编号)。
a. 混合气体颜色保持不变 b. NO2和NO的体积比保持不变
c. 每消耗1 mol SO2的同时生成1 mol SO3 d. 体系中气体平均摩尔质量保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO2)=_________(用相关字母表示)。
(4)请写出两种能提高平衡转化率的措施____________、______________。
(5)其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选择Fe2O3作催化剂的主要原因是___________
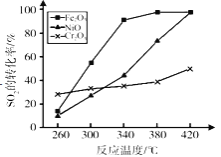
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g)。CO2 (g)的平衡物质的量浓度c (CO2)与温度T 的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2 (g)的平衡物质的量浓度c (CO2)与温度T 的关系如图所示。下列说法错误的是
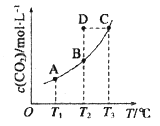
A.反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)为吸热反应
CO2(g)+H2(g)为吸热反应
B.在T2时,若反应处于状态D,则一定有υ正>υ逆
C.平衡状态A 与C 相-比,平衡状态A 的c(CO)大
D.若T1、T2 时的平衡常数分别为K1、K2则K1> K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、材料已成为当今科学研究的热点。请回答下列问题:
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示。若该原子核外电子有三层,则该元素位于周期表______族,写出A燃烧后形成的氧化物的电子式:______.
I1 | I2 | I3 | I4 | … | |
电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
(2)如图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是______(填元素符号),其原子最外层有______种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式:______。
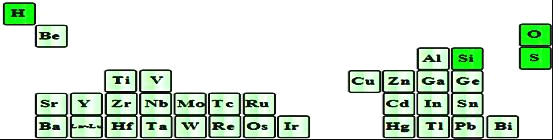
(3)上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为______,该物质为______分子(选填“极性”或“非极性”)。
(4)铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1mol该易燃气体放出37.68kJ热量,请写出此反应的热化学方程式:______。
(5)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是______(选填编号)。
a.Mg作负极,Al作正极
b.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少2/3
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
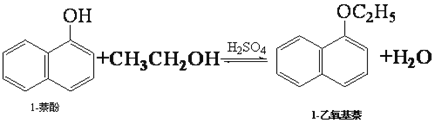
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
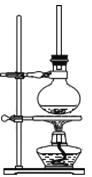
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是________。
(2)装置中长玻璃管的作用是:______________。
(3)该反应能否用实验室制备乙酸乙酯的装置_____(选填“能”或“不能”),简述理由_____________。
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是____________(选填编号)。
a.③②④① b.①②③④ c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是____________。

(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,生产工艺如下:
![]()
完成下列填空:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],反应的化学方程式为___。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:Mg(OH)2-xClxmH2O→(1-![]() )Mg(OH)2+
)Mg(OH)2+![]() MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是___。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJmol-1
Al(OH)3(s)→![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g)-87.7kJmol-1
H2O(g)-87.7kJmol-1
Mg(OH)2和Al(OH)3起阻燃作用的主要原因是___。等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是___,原因是___。
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程(框内写产物名称,箭头上标明转化条件):___
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是

A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com