
����Ŀ��ijУ��ѧѧϰС�����ʵ��Ի�ѧ��Ӧ���ʺ����й��������̽����
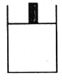
I.��С������ͼ��ʾװ�ý���þ�۷ֱ������ᡢ����(��Ϊ0.1mol/L40.00mL)�ķ�Ӧ����ش�������⣺
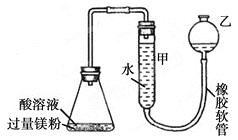
��ÿ��ʵ��������Ҫ�õ�����ƽ(�ܳ�1mg)��ȡþ��___g��
��װ�����п̶ȵļܿ����ô���___(����������)����ͼ���Ӻ�װ�ú��װ�������Եķ�����___��ʵ��������ȡ�������ʱӦ��ע���������___(���ٻش�����)��
II.��С��Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч�����������ͼ�ס�����ʾ��ʵ�顣��ش�������⣺
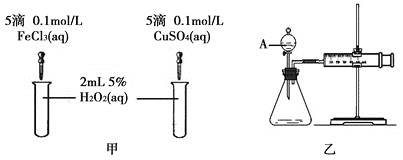
�ٶ��Է�������ͼ��ͨ���۲�___(������)�����ԱȽϵó����ۡ���ͬѧ�����FeCl3��Һ��Ϊ___(д���Լ������ʵ���Ũ��)��Ϊ��������������___��
�ڶ�����������ͼ����ʾ��ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԡ�ʵ���л���Ҫ������������___��
III.��С�����ʵ��̽��KI��Һ��FeCl3��Һ��Ӧ����һ�����ȡ���֪�÷�ӦΪ��2Fe3++2I-=2Fe2++I2���������ص�ʵ�鲽�������ʵ�鲽�����£�
��ȡ5mL0.1molL-1KI��Һ���ٵμ�56��(Լ0.2mL)0.1molL-1FeCl3��Һ
�ڳ�ַ�Ӧ����Һ�ֳ�����
��ȡ����һ�ݣ��μ��Լ�CCl4��������һ��ʱ�䣬CCl4������Ϻ�ɫ��˵����Ӧ���ɵ⡣
����ȡһ�ݣ��μ��Լ�___��Һ(���Լ�����)��������___����˵���÷�Ӧ��һ�����ȡ�
���𰸡�0.048 ��ʽ�ζ��� ������ע��������ˮ��ʹ����Һ����ڼ���Һ�棬����һ��ʱ��۲죬��Һ��߶Ȳ�ֲ��䣬��װ������������ ��ƿ��������ȴ�����£���������ʹ�ס�����Һ����ƽ������ƽ�Ӱ�Һ����͵�� �����Թ��в������ݵĿ��� 0.05mol/LFe2(SO4)3��Һ �ų�Cl-��ʵ��ĸ��� �ռ�40mL��������Ҫ��ʱ�� ���軯�� ��Һ���ɫ
��������
��I�����ݷ�Ӧ��ϵ������Ҫþ�����������װ�õ������ж��ַ�����ԭ�����Ǹ���װ�������ѹ.ǿ���γ�ˮ�������ݣ�
(II) ͨ���۲����ݲ��������ʣ��ɶ����ж�Cu2+��Fe3+��H2O2�ֽ�Ĵ�Ч��������FeCl3��ΪFe2(SO4)3�����ų�Cl-�ĸ��ţ�Ӧ������������ռ�40mL���������ʱ�䣻
(III)Ϊ����֤�÷�Ӧ����һ�����ȣ�һ������Ҫ֤���еⵥ�����ɣ���һ������Ҫ֤��Fe3+��ʣ��,֤��Fe3+�Ĵ��ڿ�ѡ���Լ�KSCN��Һ����������Һ��ΪѪ��ɫ��
I. (1) ����ͽ���þ�ķ�ӦΪ��2H++Mg=Mg2++H2![]() �������ᡢ���������Ϊ0.1mol/L40.00mL��������ͽ���֮��Ĺ�ϵʽ��þ������
�������ᡢ���������Ϊ0.1mol/L40.00mL��������ͽ���֮��Ĺ�ϵʽ��þ������![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��װ�����п̶ȵļܿ����ü�ʽ�ζ��ܴ��棻��ͼ���Ӻ�װ�ú��װ�������Եķ�����������ע��������ˮ��ʹ����Һ����ڼ���Һ�棬����һ��ʱ��۲죬��Һ��߶Ȳ�ֲ��䣬��װ�����������ã�ʵ��������ȡ�������ʱӦ��ע��������Ǵ�ƿ��������ȴ�����£���������ʹ�ס�����Һ����ƽ������ƽ�Ӱ�Һ����͵�ȣ�
�ʴ�Ϊ����ʽ�ζ��ܣ�������ע��������ˮ��ʹ����Һ����ڼ���Һ�棬����һ��ʱ��۲죬��Һ��߶Ȳ�ֲ��䣬��װ�����������ã���ƿ��������ȴ�����£���������ʹ�ס�����Һ����ƽ������ƽ�Ӱ�Һ����͵�ȣ�
II����ͼ��ͨ���۲�������ݵĿ��������ԱȽϵó������Ĵ�Ч�������Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч������Ҫʹѡ����Լ���������������ͬ�����Խ�FeCl3��Һ��Ϊ0.05mol/LFe2(SO4)3��Һ���ų�![]() ��ʵ��ĸ������ʴ�Ϊ�������Թ��в������ݵĿ�����0.05mol/LFe2(SO4)3��Һ���ų�
��ʵ��ĸ������ʴ�Ϊ�������Թ��в������ݵĿ�����0.05mol/LFe2(SO4)3��Һ���ų�![]() ��ʵ��ĸ�����
��ʵ��ĸ�����
����ͼ����ʾ��ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�����ȽϷ�Ӧ���ʿ�������ʵ������Ҫ����������Ϊ������40mL���������ʱ�䣬��Ӧʱ��Խ�̣���Ӧ����Խ�죬
�ʴ�Ϊ������40mL���������ʱ�䣻
![]() ��
��![]() ����Һ�еμӼ���KSCN��Һ��Ѫ��ɫ�����Կɵμ�KSCN��Һ����Һ��Ѫ��ɫ����˵��
����Һ�еμӼ���KSCN��Һ��Ѫ��ɫ�����Կɵμ�KSCN��Һ����Һ��Ѫ��ɫ����˵��![]() û�з�Ӧ��
û�з�Ӧ��![]() ��KI��
��KI��![]() �ķ�Ӧ��һ������
�ķ�Ӧ��һ������![]() ��
��
�ʴ�Ϊ��KSCN��Һ����Һ��Ѫ��ɫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL pH=3�Ĵ�����Һ�м���ˮϡ�ͺ�����˵����ȷ����
A. ��Һ�е������ӵ���Ŀ����
B. ��Һ��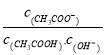 ����
����
C. ����ĵ���̶�����C��H+��������
D. �ټ���10mlpH=11��NaOH��Һ�����ҺpH=7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС��̽������(98��)�����������Ʊ�ʵ��������Ũ�ȶ�������Ӧ��Ӱ��̽����ʵ��õ��������±�(����ʵ�鷴Ӧʱ���5����)��
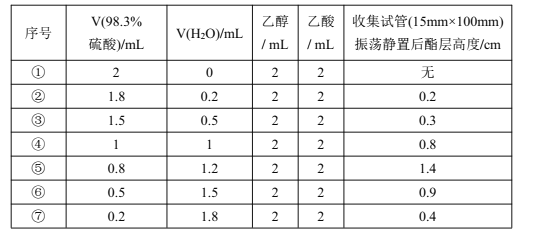
���й��ڸ�ʵ���˵������ȷ����
A.���������Ʊ�ʵ����������õĿ�����H+
B.Ũ�������ˮ���á���������������������ʹ������Ӧ�����ƶ�
C.Ũ�����ˮ�������Լ2��3��ϴ�Ч�����
D.�ݢޢ����֪c(H+)Ũ��Խ��Ӧ����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��ŵ������ѧ�������ڿ�������ӵ�ط�������Խ������λ��ѧ�ҡ�����ӵ�صĹ㷺Ӧ��Ҫ������ط����Խ�Լ��Դ����������������ʪ��ұ���ջ��շϾ���������﮵������Ƭ(��Al����LiFePO4���Բ��ϡ��������������ĵ�������)�е���Դ������������ͼ��
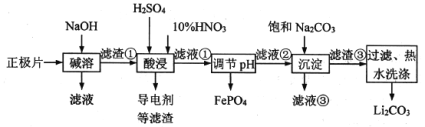
��֪��Ksp(Li2CO3)��1.6��10��3���������ʵ��ܽ��(S)�����ʾ��
T/�� | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g | S(LiH2PO4)/g |
20 | 1.33 | 34.2 | 0.039 | 126 |
80 | 0.85 | 30.5 | ���� | ���� |
(1)�����յķϾ�����ӵ�ؽ���Ԥ�ŵ硢������顢�ȴ�����Ԥ������ɸ�ֺ�������Ƭ�����з�������Ϊ��������__________��
A.�Ͼ�����ӵ���ڴ���֮ǰ��Ҫ���г��ŵ磬�����ں��������У�����������Ἧ���ͷţ����ܻ���ɰ�ȫ������
B.Ԥ�ŵ�ʱ����е�������������������������Ƭ���Ԫ�صĻ����ʡ�
C.�ȴ������̿��Գ�ȥ�Ͼ�����ӵ���е������л��̼�۵ȡ�
(2)д������ʱ��Ҫ������Ӧ�����ӷ���ʽ��________��
(3)Ϊ�������Ľ����ʣ������顢���衢�����⣬���ɲ��õķ�����______��(д��һ�ּ���)
(4)���ʱ���������3.36 L NOʱ���ܽ�LiFePO4________mol(�������ʲ���HNO3��Ӧ)��
(5)����Һ����c(Li��)��4 mol��L��1������������Na2CO3�����е�LiԪ��ռԭLiԪ��������90%��������Һ����c(CO32��)��__________mol/L��
(6)������������ˮϴ������ԭ����________��
(7)��ҵ�Ͻ����յ�Li2CO3��FePO4����������̿�ڻ�ϸ������������Ʊ�LiFePO4��д����Ӧ�Ļ�ѧ����ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ���������ӽ���Ĥ���к�ˮ�����ķ������乤��ԭ���ɼ�ʾ����ͼ��ʾ������˵������ȷ���ǣ� ��
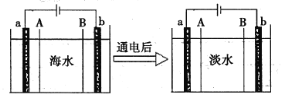
A.ͨ���a�������ܷ�����Ӧ2Cl����2e����Cl2��
B.ͼ��AΪ�����ӽ���Ĥ��BΪ�����ӽ���Ĥ
C.ͨ���b������������Һ��pH���
D.�����������������ӽ������ȶ��Ǻ�ˮ�����ij��÷���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɼ״��������ѵ����ȼ�ϡ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
��CH4(g)��H2O(g)![]() CO(g)��3H2(g) ��H1����206.1 kJ/mol
CO(g)��3H2(g) ��H1����206.1 kJ/mol
��CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H2����247.3 kJ/mol
2CO(g)��2H2(g) ��H2����247.3 kJ/mol
��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H3
CO2(g)��H2(g) ��H3
��ش��������⣺
(1)��һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ��ʾ��

��Ӧǰ5min��ƽ����Ӧ����v(H2)��______��10minʱ���ı���������������_______(�����)��
A.ѹ����� B.������� C.�����¶� D.�������
(2)��ͼ��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䡣
��֪��������CH4��ת������ʱ��仯��ͼ����ͼ��ʾ������ͼ�л�����������CH4��ת������ʱ��仯��ͼ��_______��
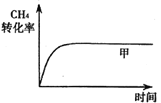
(3)��Ӧ���С�H3��________��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K��1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ���������
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ��________(�����)��
a.v(��)>v(��) b.v(��)<v(��) c.v(��)��v(��) d.���ж�
(4)800Kʱ�����������ܱ������и�����2 mol H2��1 mol CO��������Ӧ��2H2(g)��CO(g)CH3OH(g) ��H<0������������ʼ�����ͬ���������ڷ�Ӧ�����б���ѹǿ���䣬����������������䣬������ά�־��ȣ����������Խ�����ѧƽ�⡣
��. ��.
��. ��.
��.
�ٴﵽƽ��ʱ��ƽ�ⳣ��K(��)________K(��)��K(��)________K(��)(������������������������)��
�ڴﵽƽ��ʱH2��Ũ��c(H2)(��)________c(H2)(��)��c(H2)(��)________c(H2)(��)(������������������������)��
(5)���Լ״�Ϊȼ�ϵĵ���У��������ҺΪ���ԣ������ĵ缫��ӦʽΪ_________���״�Ӧ����ȼ�ϵ�رȼ״�ֱ������ȼ��ȼ�յ��ŵ���_______(�ش�һ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������![]() ����������
����������![]() ��
��![]() ��Һ100mL�������й�˵����ȷ����( )
��Һ100mL�������й�˵����ȷ����( )
A.Ҫ���ʵ�����ȡ16.0g![]() ����
����
B.��ʵ��ֻ��Ҫ�õ���������������ƽ��ҩ�ס����������ձ���100mL������ƿ
C.����ʱ���ӿ̶��ᵼ��������ҺŨ��ƫ��
D.����ʱ������ƿ�������������������ˮ���ᵼ����ҺŨ��ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ǵ�����������أ���ش�
��1����������Ҫע����ʳƽ�⣬����������_______������ţ���ͬ��ʳ���������______ʳ������� �ڼ���
��2�������ֳ���ҩ��ٰ�˾ƥ�֡�����ù�ء���θ��ƽ������Ƽ ijͬѧθ����࣬Ӧ�÷���______������ţ���ͬ��������ҩ��ȫ�Ƕȿ��ǣ�ʹ��ǰҪ����Ƥ�������Բ��Ե���_____�����ھ����˷����ã����ʰ�ί���Ͻ��˶�Ա���õ���_________��
��3��ƻ��֭������ϲ������Ʒ���������к���Fe2+����ե��ƻ��֭�ڿ����л���dz��ɫ��Ϊ�ػ�ɫ����ե֭ʱ����ά����C������Ч��ֹ��������������˵��ά����C����________������ţ����������� �ڻ�ԭ�� �ۼ��� ������
��4��ʳ��ֲ���ͽ����������ø��������ˮ��Ϊ��֬�����_________��д���ƣ��������������ɶ�����̼��ˮ���ṩ����������Ϊ�ϳ����������������ʵ�ԭ�ϣ�
��5��������������������ȱ����ƶѪ��ijƶѪ����ÿ���벹��1.4g��Ԫ�أ�����õ�ҩ���к�������������������Ϊ_________g��
��6������������ɵ����ʵĻ����ṹ��Ԫ���������һ�����еĹ������ǰ�������NH2����____��д�ṹ��ʽ�����ƣ��������й��ж�ʮ���ְ����ᣬ������������________�����������������������ϳɵİ������Ϊ������谱���
��7�������ڵ���ø������������ˮ��Ϊ�����ǣ�C6H12O6�������������������ڱ��������ɶ�����̼��ˮ��д�������������ڱ������Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA+B��C ��H ��0������������ �� A+B��X ��H��0 �� X��C ��H��0 ������ʾ��ͼ�У�����ȷ��ʾ�ܷ�Ӧ�����������仯����
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com