
【题目】某校化学兴趣小组探究恒温(98℃)下乙酸乙酯制备实验中硫酸浓度对酯化反应的影响探究。实验得到数据如下表(各组实验反应时间均5分钟):
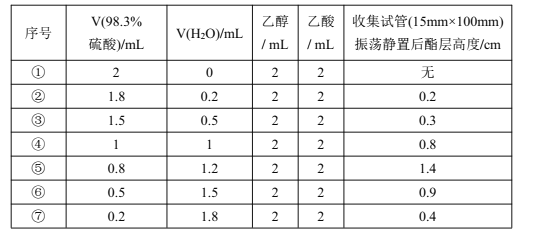
下列关于该实验的说法不正确的是
A.乙酸乙酯制备实验中起催化作用的可能是H+
B.浓硫酸的吸水作用、乙酸乙酯的蒸出均可以使酯化反应正向移动
C.浓硫酸和水以体积比约2∶3混合催化效果最好
D.⑤⑥⑦组可知c(H+)浓度越大,反应速率越慢
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LSO3中含有氧原子数目为3NA
B.在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等
C.18 g D2O中含有的质子数目为10NA
D.含0.5 mol H2SO4的稀溶液与含0.5mol Ba(OH)2 的晶体完全中和所放出的热量为中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于体积相同的①(NH4) 2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是( )
A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>①
B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是①
C.溶液的pH相同时,由水电离出的![]() 大小顺序是③>②>①
大小顺序是③>②>①
D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图海水综合利用的工业流程图判断,下列说法正确的是
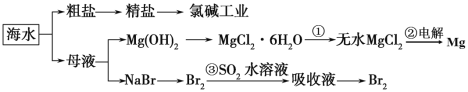
A.过程①中将MgCl2·6H2O灼烧即可制得无水MgCl2
B.在工业上可用电解MgCl2溶液的方法生产金属镁
C.过程③反应后溶液呈强酸性,故生产中需解决其对金属设备的腐蚀问题
D.氯碱工业生产中适当增加电流强度可增大电解反应的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】留兰香(薄荷中的一种)可用来治疗感冒咳嗽、胃痛腹胀、神经性头痛等,其有效成分为葛缕酮(结构简式如图)。下列有关葛缕酮的说法正确的是
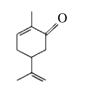
A.葛缕酮的分子式为C10H16O
B.葛缕酮使溴水和酸性KMnO4溶液褪色的原理相同
C.葛缕酮中所有碳原子可能处于同一个平面
D.羟基直接连苯环且苯环上有2个取代基的葛缕酮的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
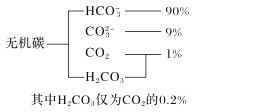
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________。已知春季海水pH=8.1,预测冬季海水碱性将会_______(填“增强”或“减弱”),理由是_________________。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________(填字母)。
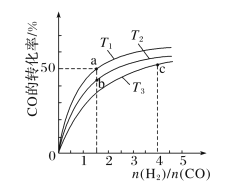
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
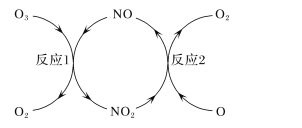
①NO的作用是_________________。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1 。
反应2:热化学方程式为____________________________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
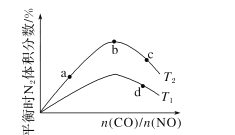
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br-
C.![]() =0.1mol·L-1的溶液:Na+、K+、SO32-、NO3-
=0.1mol·L-1的溶液:Na+、K+、SO32-、NO3-
D.水电离产生的c(H+)为1×10-l2mol·L-1的溶液:AlO2-、Na+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组设计实验对化学反应速率和限度有关问题进行探究:
I.甲小组用如图所示装置进行镁粉分别与盐酸、醋酸(均为0.1mol/L40.00mL)的反应,请回答相关问题:
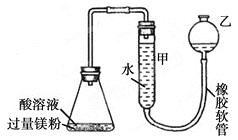
①每次实验至少需要用电子天平(能称准1mg)称取镁粉___g;
②装置中有刻度的甲管可以用代替___(填仪器名称),按图连接好装置后,检查装置气密性的方法是___。实验结束后读取气体体积时应该注意的问题是___(至少回答两点)。
II.乙小组为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图甲、乙所示的实验。请回答相关问题:
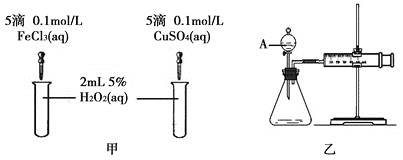
①定性分析:如图甲可通过观察___(填现象),定性比较得出结论。有同学提出将FeCl3溶液改为___(写出试剂及物质的量浓度)更为合理,其理由是___。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中还需要测量的数据是___。
III.丙小组设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。已知该反应为:2Fe3++2I-=2Fe2++I2。请完成相关的实验步骤和现象。实验步骤如下:
①取5mL0.1molL-1KI溶液,再滴加56滴(约0.2mL)0.1molL-1FeCl3溶液
②充分反应后,将溶液分成两份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂___溶液(填试剂名称),若现象___,则说明该反应有一定的限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料,印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
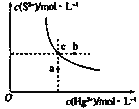
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com