
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LSO3中含有氧原子数目为3NA
B.在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等
C.18 g D2O中含有的质子数目为10NA
D.含0.5 mol H2SO4的稀溶液与含0.5mol Ba(OH)2 的晶体完全中和所放出的热量为中和热
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 红棕色的NO2加压后颜色先变深后变浅 B. 温度过高对合成氨不利
C. 钢铁在潮湿的空气中容易生锈 D. 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种常见的单质或化合物在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
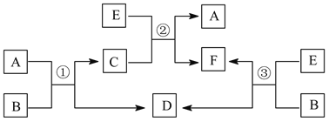
(1)若B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应③的化学方程式______________。
(2)若B由两种元素组成,其简单离子的电子层结构相同;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,11.6 g A和E组成的混合气体与足量的B固体反应,固体增重3.6 g,则A、E混合气中E 的体积分数为_________________________。
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则B、C、F氧化性由强到弱顺序为(用离子符号表示)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 等物质的量的硫蒸气和固体硫分别完全燃烧,前者放出热量多
B. 由C(石墨)=C(金刚石) △H =+1.90 kJ/mol可知,金刚石比石墨稳定
C. 在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)= 2H2O(l) △H=-285.8kJ/mol
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中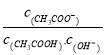 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究恒温(98℃)下乙酸乙酯制备实验中硫酸浓度对酯化反应的影响探究。实验得到数据如下表(各组实验反应时间均5分钟):
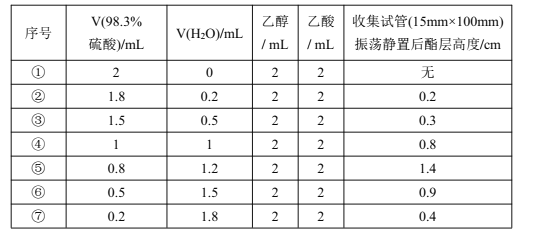
下列关于该实验的说法不正确的是
A.乙酸乙酯制备实验中起催化作用的可能是H+
B.浓硫酸的吸水作用、乙酸乙酯的蒸出均可以使酯化反应正向移动
C.浓硫酸和水以体积比约2∶3混合催化效果最好
D.⑤⑥⑦组可知c(H+)浓度越大,反应速率越慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com