
【题目】留兰香(薄荷中的一种)可用来治疗感冒咳嗽、胃痛腹胀、神经性头痛等,其有效成分为葛缕酮(结构简式如图)。下列有关葛缕酮的说法正确的是
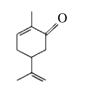
A.葛缕酮的分子式为C10H16O
B.葛缕酮使溴水和酸性KMnO4溶液褪色的原理相同
C.葛缕酮中所有碳原子可能处于同一个平面
D.羟基直接连苯环且苯环上有2个取代基的葛缕酮的同分异构体有12种
【答案】D
【解析】
本题考查有机物的知识,碳碳双键使溴水和酸性KMnO4溶液褪色,但褪色原理不同,前者是加成反应,后者是氧化反应;有机物中碳碳双键、叁键、苯环才具有所有碳共面。由图可知,分子式为C10H14O,羟基直接连苯环,且苯环上有2个取代基,还剩-C4H9,其结构有四种,分别是![]() 、
、![]() 、
、![]() 、
、 ,每一种在苯环上与羟基分别有邻间对3种异构体,共12种。
,每一种在苯环上与羟基分别有邻间对3种异构体,共12种。
A. 根据图示,葛缕酮的不饱和度为4,所以分子式为C10H14O,A项错误;
B. 葛缕酮使溴水和酸性KMnO4溶液褪色,但原理不同,前者是加成反应,后者是氧化反应;B项错误;
C. 葛缕酮中所有碳原子不可能处于同一个平面,C项错误;
D. 分子式为C10H14O,羟基直接连苯环,且苯环上有2个取代基,还剩-C4H9,其结构有四种,分别是![]() 、
、![]() 、
、![]() 、
、 ,每一种在苯环上与羟基分别有邻间对3种异构体,共12种,D项正确。
,每一种在苯环上与羟基分别有邻间对3种异构体,共12种,D项正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种常见的单质或化合物在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
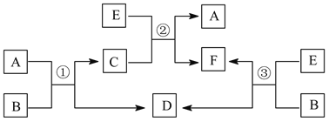
(1)若B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应③的化学方程式______________。
(2)若B由两种元素组成,其简单离子的电子层结构相同;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,11.6 g A和E组成的混合气体与足量的B固体反应,固体增重3.6 g,则A、E混合气中E 的体积分数为_________________________。
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则B、C、F氧化性由强到弱顺序为(用离子符号表示)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
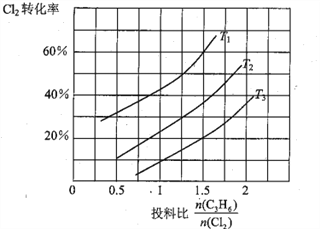
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD= -lg[D+],以下关于pD的叙述不正确的是( )
A.中性溶液的pD〉7.0
B.含0.01mol NaOD的D2O溶液1L,其pD=12.0
C.溶解0.01molDCl的D2O溶液1L,其pD=2.0
D.在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,其pD=1.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,其中:X的负价阴离子核外电子排布和氙原子的核外电子排布相同;Y有两种氧化物,其水溶液呈强碱性,在Y的两种氧化物中,Y的质量分数分别是74.19%和58.79%,这两种氧化物的摩尔质量分别是62g/mol和78g/mol。在X和Y化合生成物的水溶液中滴入Z单质的水溶液,溶液由无色变为深黄色。Z和X在同一主族,相差2个周期。试回答:
(1)写出三种元素的名称:X_________,Y________,Z_________ 。
(2)两种氧化物分别为_________和___________。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,其离子方程式为(并标明电子转移方向和数目)_________
(4)X与Y形成的化合物比Z与Y 形成的化合物熔点:________(“高”或“低”)其原因是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究恒温(98℃)下乙酸乙酯制备实验中硫酸浓度对酯化反应的影响探究。实验得到数据如下表(各组实验反应时间均5分钟):
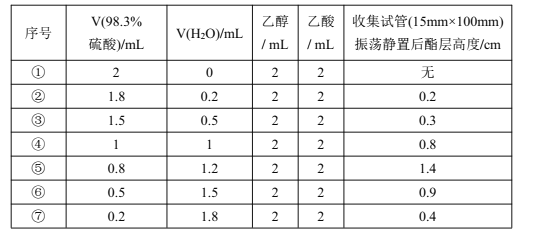
下列关于该实验的说法不正确的是
A.乙酸乙酯制备实验中起催化作用的可能是H+
B.浓硫酸的吸水作用、乙酸乙酯的蒸出均可以使酯化反应正向移动
C.浓硫酸和水以体积比约2∶3混合催化效果最好
D.⑤⑥⑦组可知c(H+)浓度越大,反应速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为天然气、页岩气、可燃冰的主要成分,拥有最稳定的烷烃分子结构,具有高度的四面体对称性,极难在温和的条件下对其活化。因此,甲烷的选择活化和定向转化一直是世界性的难题。我国科学家经过长达6年的努力,研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂材料,在室温条件下以H2O2为氧化剂直接将甲烷氧化成C1(只含一个C原子)含氧化合物,被业内认为是甲烷化学领域的重要突破。请回答下列问题:
(1)Cu原子基态原子的外围电子排布式为____________。
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____(减弱”或“不变”)。铁晶体中粒子之间作用力类型是__________________。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①它们的沸点分别为64.7、-195℃、100.8℃,其主要原因是_________________;
②CH4 和HCHO比较,键角较大的是_________,主要原因是_____________。
(4)配离子的颜色与d-d电子跃迁的分裂能大小有关,1个电子从较低的d轨道跃迁到较高能量的轨道所需的能量为的分裂能,用符号△表示。分裂能△[Co(H2O)62+]_____________△[Co(H2O)63+](填“>”“<”或“=”),理由是_________________。
(5)钴晶胞和白铜(铜镍合金)晶胞分别如图1、图2所示。
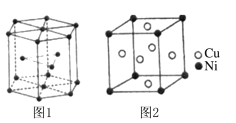
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dg·cm-3 ,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____________pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其工作原理可简单表示如下图所示,下列说法不正确的是( )
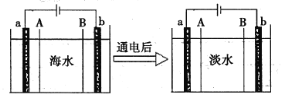
A.通电后a极区可能发生反应2Cl--2e-=Cl2↑
B.图中A为阳离子交换膜,B为阴离子交换膜
C.通电后b极区附近,溶液的pH变大
D.蒸馏法、电渗析法、离子交换法等都是海水淡化的常用方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②中与气体B充分反应,打开夹子,可发现试管①中的水立刻沸腾了。则液体A和气体B的组合不可能是下列选项中的( )
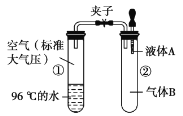
A.氢氧化钠溶液、二氧化碳B.水、氨气
C.氢氧化钠溶液、一氧化氮D.水、二氧化氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com