
【题目】甲烷作为天然气、页岩气、可燃冰的主要成分,拥有最稳定的烷烃分子结构,具有高度的四面体对称性,极难在温和的条件下对其活化。因此,甲烷的选择活化和定向转化一直是世界性的难题。我国科学家经过长达6年的努力,研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂材料,在室温条件下以H2O2为氧化剂直接将甲烷氧化成C1(只含一个C原子)含氧化合物,被业内认为是甲烷化学领域的重要突破。请回答下列问题:
(1)Cu原子基态原子的外围电子排布式为____________。
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____(减弱”或“不变”)。铁晶体中粒子之间作用力类型是__________________。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①它们的沸点分别为64.7、-195℃、100.8℃,其主要原因是_________________;
②CH4 和HCHO比较,键角较大的是_________,主要原因是_____________。
(4)配离子的颜色与d-d电子跃迁的分裂能大小有关,1个电子从较低的d轨道跃迁到较高能量的轨道所需的能量为的分裂能,用符号△表示。分裂能△[Co(H2O)62+]_____________△[Co(H2O)63+](填“>”“<”或“=”),理由是_________________。
(5)钴晶胞和白铜(铜镍合金)晶胞分别如图1、图2所示。
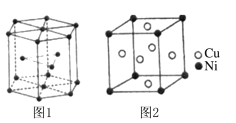
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dg·cm-3 ,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____________pm(列出计算式)。
【答案】3d10s1; 减弱; 金属键; CH3OH、HCOOH中存在氢键,CH3OH中氢键较弱,而HCHO只存在范德华力; HCHO CH4构型为正四面体,键角为109。28〃,HCHO为平面三角形,键角为120。; <; 前者带2个正电荷,后者带3个正电荷,后者对电子的吸引能力较大; 六方最密堆积; 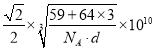
【解析】
(1)Cu原子基态原子的外围电子排布式为3d10s1;
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力减弱。铁晶体中粒子之间作用力类型为金属键。
(3) ①常温下 CH3OH、HCHO、 HCOOH的沸点不同,是因为CH3OH与HCOOH有氢键,且CH3OH中氢键比HCOOH中氢键弱,而HCHO中只有范德华力。
②CH4 和HCHO比较,键角较大的是CH4,主要原因是CH4构型为正四面体,键角为109。28〃,HCHO为平面三角形,键角为120。;
(4)由于Co(H2O)62+带2个正电荷,Co(H2O)63+带3个正电荷,后者对电子的吸引能力较大;所以分裂能前者小于后者;
(5) ①钴晶胞堆积方式的名称为六方最密堆积;
②由图可知,白铜晶胞中含有Ni原子1个,Cu原子3个,根据密度公式![]() ,可得出
,可得出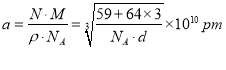 ,所以两个面心上铜原子最短核间距为
,所以两个面心上铜原子最短核间距为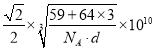 pm。
pm。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 的同分异构体中,有醇、酚、酯类物质
的同分异构体中,有醇、酚、酯类物质
B.1 mol![]() 最多能与4 mol NaOH反应
最多能与4 mol NaOH反应
C.纯净物C4H8的核磁共振氢谱峰最多为4
D.化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A.c水(H+)=1×10-12 mol·L -1的溶液:Al3+、Fe3+、Cl-、SO42-
B.![]() =1×10-13mol·L -1的溶液:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L -1的溶液:NH4+、Ca2+、Cl-、NO3-
C.澄清透明的无色溶液:K+、NH4+、MnO4-、HCO3-
D.和Al反应放出H2的溶液:Mg2+、Cu2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】留兰香(薄荷中的一种)可用来治疗感冒咳嗽、胃痛腹胀、神经性头痛等,其有效成分为葛缕酮(结构简式如图)。下列有关葛缕酮的说法正确的是
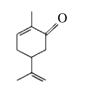
A.葛缕酮的分子式为C10H16O
B.葛缕酮使溴水和酸性KMnO4溶液褪色的原理相同
C.葛缕酮中所有碳原子可能处于同一个平面
D.羟基直接连苯环且苯环上有2个取代基的葛缕酮的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计如下装置进行原电池原理的探究。一段时间后取出铜棒洗净,发现浸泡在稀硝酸铜溶液中铜棒变细,浓硝酸铜溶液中铜棒变粗。对该实验的说法正确的是
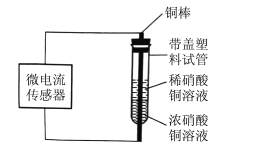
A.处于稀硝酸中的铜棒为电池的正极,电极反应为:Cu2+ +2e- =Cu
B.该装置可以实现“零能耗”镀铜
C.配置上述试验所用硝酸铜溶液应加入适量的硝酸溶液使铜棒溶解
D.铜棒上部电势高,下部电势低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br-
C.![]() =0.1mol·L-1的溶液:Na+、K+、SO32-、NO3-
=0.1mol·L-1的溶液:Na+、K+、SO32-、NO3-
D.水电离产生的c(H+)为1×10-l2mol·L-1的溶液:AlO2-、Na+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是( )
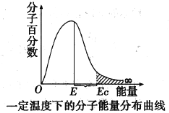
A.图中Ec与E之差表示活化能
B.升高温度,图中阴影部分面积会增大
C.使用合适的催化剂,E不变,Ec变小
D.能量大于Ec的分子间发生的碰撞一定是有效碰撞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-=PbSO4
D.工作时电解质的密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是硫酸试剂标签上的部分内容。下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1mol锌与足量的该硫酸反应产生2g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com