
【题目】下列关于有机物的说法正确的是
A. 的同分异构体中,有醇、酚、酯类物质
的同分异构体中,有醇、酚、酯类物质
B.1 mol![]() 最多能与4 mol NaOH反应
最多能与4 mol NaOH反应
C.纯净物C4H8的核磁共振氢谱峰最多为4
D.化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】同温同压下两相同圆底烧瓶中分别充满①NH3,②NO2倒扣于水中进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种常见的单质或化合物在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
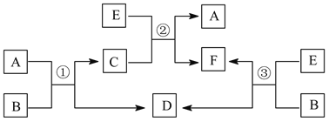
(1)若B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应③的化学方程式______________。
(2)若B由两种元素组成,其简单离子的电子层结构相同;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,11.6 g A和E组成的混合气体与足量的B固体反应,固体增重3.6 g,则A、E混合气中E 的体积分数为_________________________。
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则B、C、F氧化性由强到弱顺序为(用离子符号表示)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系

据此判断下列说法中正确的是( )
A. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
B. 金刚石比石墨稳定
C. S(g)+O2(g)===SO2(g)ΔH1 , S(s)+O2(g)===SO2(g)ΔH2。则ΔH1>ΔH2
D. 石墨转变为金刚石是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.K37C1O3与浓盐酸(HC1)在加热条件时生成氯气的化学方程式:K37C1O3+6HC1=K37C1+3C12↑+3H2O
B.表示氢气燃烧热的热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
C.将1mL—2mL氯化铁饱和溶液滴加到20mL沸水中所发生反应的离子方程式: Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH—=NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
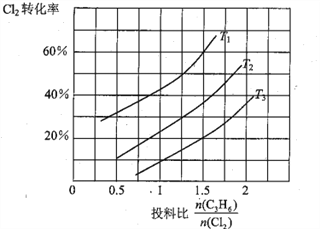
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为天然气、页岩气、可燃冰的主要成分,拥有最稳定的烷烃分子结构,具有高度的四面体对称性,极难在温和的条件下对其活化。因此,甲烷的选择活化和定向转化一直是世界性的难题。我国科学家经过长达6年的努力,研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂材料,在室温条件下以H2O2为氧化剂直接将甲烷氧化成C1(只含一个C原子)含氧化合物,被业内认为是甲烷化学领域的重要突破。请回答下列问题:
(1)Cu原子基态原子的外围电子排布式为____________。
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____(减弱”或“不变”)。铁晶体中粒子之间作用力类型是__________________。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①它们的沸点分别为64.7、-195℃、100.8℃,其主要原因是_________________;
②CH4 和HCHO比较,键角较大的是_________,主要原因是_____________。
(4)配离子的颜色与d-d电子跃迁的分裂能大小有关,1个电子从较低的d轨道跃迁到较高能量的轨道所需的能量为的分裂能,用符号△表示。分裂能△[Co(H2O)62+]_____________△[Co(H2O)63+](填“>”“<”或“=”),理由是_________________。
(5)钴晶胞和白铜(铜镍合金)晶胞分别如图1、图2所示。
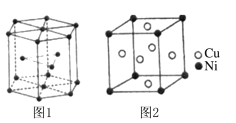
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dg·cm-3 ,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____________pm(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com