
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-=PbSO4
D.工作时电解质的密度减小
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
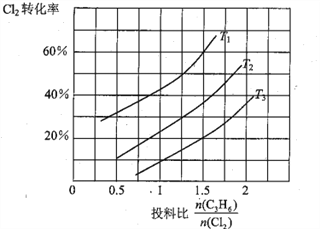
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为天然气、页岩气、可燃冰的主要成分,拥有最稳定的烷烃分子结构,具有高度的四面体对称性,极难在温和的条件下对其活化。因此,甲烷的选择活化和定向转化一直是世界性的难题。我国科学家经过长达6年的努力,研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂材料,在室温条件下以H2O2为氧化剂直接将甲烷氧化成C1(只含一个C原子)含氧化合物,被业内认为是甲烷化学领域的重要突破。请回答下列问题:
(1)Cu原子基态原子的外围电子排布式为____________。
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____(减弱”或“不变”)。铁晶体中粒子之间作用力类型是__________________。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①它们的沸点分别为64.7、-195℃、100.8℃,其主要原因是_________________;
②CH4 和HCHO比较,键角较大的是_________,主要原因是_____________。
(4)配离子的颜色与d-d电子跃迁的分裂能大小有关,1个电子从较低的d轨道跃迁到较高能量的轨道所需的能量为的分裂能,用符号△表示。分裂能△[Co(H2O)62+]_____________△[Co(H2O)63+](填“>”“<”或“=”),理由是_________________。
(5)钴晶胞和白铜(铜镍合金)晶胞分别如图1、图2所示。
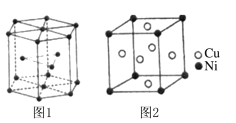
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dg·cm-3 ,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____________pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其工作原理可简单表示如下图所示,下列说法不正确的是( )
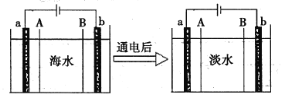
A.通电后a极区可能发生反应2Cl--2e-=Cl2↑
B.图中A为阳离子交换膜,B为阴离子交换膜
C.通电后b极区附近,溶液的pH变大
D.蒸馏法、电渗析法、离子交换法等都是海水淡化的常用方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池装置(见图),下列分析正确的是( )

A. 一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B. 原电池工作时,Cu电极流出电子,发生反应:Cu-2e-===Cu2+
C. 原电池工作时,Zn电极发生还原反应:Zn2++2e-===Zn
D. 原电池工作时的总反应为Zn+Cu2+===Zn2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用![]() 晶体来配制
晶体来配制![]() 的
的![]() 溶液100mL,下列有关说法正确的是( )
溶液100mL,下列有关说法正确的是( )
A.要完成实验需称取16.0g![]() 晶体
晶体
B.本实验只需要用到的仪器有托盘天平、药匙、玻璃棒、烧杯、100mL的容量瓶
C.定容时俯视刻度线会导致所配溶液浓度偏高
D.配制时若容量瓶不干燥,含有少量的蒸馏水,会导致溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是

A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②中与气体B充分反应,打开夹子,可发现试管①中的水立刻沸腾了。则液体A和气体B的组合不可能是下列选项中的( )
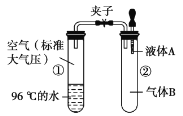
A.氢氧化钠溶液、二氧化碳B.水、氨气
C.氢氧化钠溶液、一氧化氮D.水、二氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,氯气与NaOH溶液反应可生成NaCl、NaClO和NaClO3。下列判断不正确的是( )
A.若反应过程中消耗2mol氯气,则转移电子数目可能为3NA
B.反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:6:1
C.氯气与氢氧化钠反应过程中消耗氯气与NaOH的物质的量之比一定为1:2
D.若氢氧化钠与氯气恰好完全反应,则反应后所得溶液中总是存在:c(Na+)=c(Cl-)+c(ClO-)+c(ClO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com