
【题目】在一定温度下,氯气与NaOH溶液反应可生成NaCl、NaClO和NaClO3。下列判断不正确的是( )
A.若反应过程中消耗2mol氯气,则转移电子数目可能为3NA
B.反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:6:1
C.氯气与氢氧化钠反应过程中消耗氯气与NaOH的物质的量之比一定为1:2
D.若氢氧化钠与氯气恰好完全反应,则反应后所得溶液中总是存在:c(Na+)=c(Cl-)+c(ClO-)+c(ClO3-)
【答案】D
【解析】
A.若氯气与NaOH发生3Cl2+6NaOH=5NaCl+NaClO3+3H2O转移电子数最多,1mol转移![]() mol电子;发生Cl2+2NaOH=NaCl+NaClO+H2O转移电子最少,转移1mol电子,2mol氯气反应,可能转移3mol电子,A判断正确;
mol电子;发生Cl2+2NaOH=NaCl+NaClO+H2O转移电子最少,转移1mol电子,2mol氯气反应,可能转移3mol电子,A判断正确;
B.反应停止时,n(NaClO):n(NaCl):n(NaClO3)为1:6:1时,得电子数目为1×1+5×1=6,失电子数目为1×6,相等,B判断正确;
C.根据NaCl、NaClO、NaClO3可知,钠离子和氯原子的物质的量之比为1:1,则参加反应所需氯气与NaOH的物质的量之比为1:2,C判断正确;
D.根据溶液中离子电荷守恒,c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-)+3c(ClO3-),D判断错误;
答案为D。


科目:高中化学 来源: 题型:
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-=PbSO4
D.工作时电解质的密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是硫酸试剂标签上的部分内容。下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1mol锌与足量的该硫酸反应产生2g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5mol·L-1一元强酸HA溶液和未知浓度的一元强碱BOH溶液以1∶2的体积比混合,所得溶液的c(OH-)=0.1mol·L-1,用此碱溶液中和20mL一元弱酸HC[该酸溶液c(H+)=0.01mol·L-1],当恰好完全反应时,用5mLB溶液,求弱酸HC的电离度____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
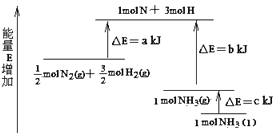
A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后加热熔融可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体(粗产品)。
请回答下列问题:
(1)步骤一加热熔融应在________(填序号)进行。
A.铁坩埚 B.氧化铝坩埚 C.瓷坩埚 D.石英
(2)为进一步提高粗产品(高锰酸钾晶体)的纯度,常采用的实验方法是_____________。
(3)KMnO4、MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等物质的量的氯气消耗KMnO4与MnO2的物质的量之比为________________。
(4)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡),记录的现象如表:
滴入KMnO4溶液的次序(假设每滴溶液体积相等) | 滴入的KMnO4溶液紫色褪去的时间 |
先滴入第1滴 | 1min |
褪色后再滴入第2滴 | 15s |
褪色后再滴入第3滴 | 3s |
褪色后再滴入第4滴 | 1s |
请分析高锰酸钾溶液褪色时间变化的原因:_________。
(5)我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。我校某同学通过查阅资料,拟采用如下方法测定2019年暑假新装修的焕然一新的明德楼教室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O。
实验操作:用容积为1000mL用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如图),当酸性高锰酸钾溶液正好褪色时,停止注入。

①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液l000mL,需0.1000mol/L的酸性KMnO4溶液的体积为___________。
②装置中多孔玻璃球泡的作用是__________。
③该同学在206教室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第250次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液恰好褪色。请通过计算判断,该教室空气中甲醛含量________(填“已”或“未”)超标。若未超标,该教室内空气中甲醛(HCHO)含量为________mg/m3;若已超标,请举出减少室内空气污染的一条合理措施:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
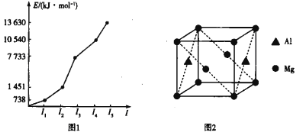
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:
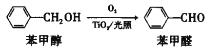
①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。
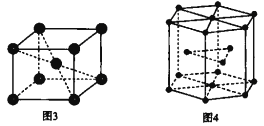
①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,观察溶液颜色变化,并和另一份做对比_____。
实验现象 | 实验结论 | |
实验1 | ||
实验2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:

回答下列问题:
(1)物质A的含氧官能团的名称为___________;B→C的转化属于___________反应(填反应类型)
(2)上述流程中设计A→B步骤的目的是________;F分子中共平面的原子最多有________个。
(3)D与银氨溶液发生反应的化学方程式为___________。
(4)福酚美克具有多种同分异构体.写出其中符合下列条件的有机物结构简式:___________和___________。
①含有-CONH2;
②能与FeCl3溶液发生显色反应;
③核磁共振氢谱的吸收峰数目有4个。
(5)参照上述合成路线和信息,以乙醇为原料(无机试剂任选),设计制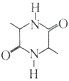 的合成路线:___________。
的合成路线:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com